
����Ŀ��һ���¶��£���һ�ݻ�Ϊ5 L�ĺ����ܱ������г���0.4 mol SO2��0.2 mol O2��������Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H����196 kJ/mol������Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊ��ʼʱ��0.7������ش��������⣺
2SO3(g) ��H����196 kJ/mol������Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊ��ʼʱ��0.7������ش��������⣺
��1 ���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��___________(����ĸ)��
A��SO2��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2 B�������������ѹǿ����
C�������ڻ��������ܶȱ��ֲ��� D��SO3�����ʵ������ٱ仯
E��SO2���������ʺ�SO3�������������
��2����SO2��ת���ʣ�_______________���ڴﵽƽ��ʱ��Ӧ�ų�������Ϊ____________kJ���۴��¶��¸÷�Ӧ��ƽ�ⳣ��K��__________��
��3����ͼ��ʾƽ��ʱSO2�����������ѹǿ���¶ȱ仯�����ߣ���
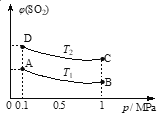
���¶ȹ�ϵ��T1________T2(���������������������ͬ)��
��ƽ�ⳣ����ϵ��KA_________KB��KA_________KD��
���𰸡� BDE 90% 35.28 20250 �� �� ��
��������(1)SO2��O2��SO3����Ũ�ȱ�Ϊ2��1��2,��ƽ��״̬�ޱ�Ȼ��ϵ,������Ϊ����ƽ��ı�־,����������ѹǿ�淴Ӧ���ж��仯,����ѹǿ����,����ƽ��;��������������,�����������,��������ܶ�Ҳ����,������Ϊƽ��״̬��־;SO3�����ʵ������淴Ӧ���ж������仯��,���䲻��ʱ,��ʾ��Ӧ�ѽ���ƽ��;SO2������������v(SO2)��,SO3����������v(SO3)��,��v(SO2)��=v(SO3)��,����v(SO2)��=v(SO2)��,����ƽ�⽨���ĸ�����־�����Կ���Ϊƽ��״̬��־����b��d��e��
(2) 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
��ʼ(mol) 0.4 0.2 0
�仯(mol) x x/2 x
ƽ��(mol) 0.4-x 0.2-x/2 x
T��V�㶨,�����ѹǿ֮�ȵ������ʵ���֮��![]() =
=![]() ,���x=0.36,��SO2ת����Ϊ:
,���x=0.36,��SO2ת����Ϊ:![]() ��100%=90%���ų�����Ϊ:
��100%=90%���ų�����Ϊ:![]() kJ��mol-1��0.4 mol��90%="35.28" kJ,K=
kJ��mol-1��0.4 mol��90%="35.28" kJ,K=![]() =
=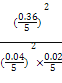 ="20" 250��
="20" 250��
(3)�÷�Ӧ�Ƿ��ȷ�Ӧ,�¶�����ƽ������,SO2�����������,����T2��T1,ƽ�ⳣ��ֻ���¶��й�,�¶Ȳ���,Kֵ����,��KA=KB,����,ƽ������,Kֵ��С,KA��KD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��11.2g Fe����һ������HNO3��ַ�Ӧ������Fe2+��Fe3+�����ʵ���֮��Ϊ1:4�������ɵ�������һ������O2��Ϻ�ͨ��ˮ�У����������ʣ�࣬��ͨ������������ʵ�����
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
���𰸡�B
��������
�������ᷴӦ����Fe2+��Fe3+�͵��������������������һ������O2��Ϻ�ͨ��ˮ�У����������ʣ�࣬˵��������������O2��ȫ��Ӧ�������ᣬ����ԭ����������������������ͬ������ʧȥ���ӵ���Ŀ��O2�õ�������Ŀ��ͬ���ݴ˼��㡣
�������֪������ԭ��������뵪����������O2��ȫ��Ӧ�������������ͬ������ʧȥ���ӵ���Ŀ��O2�õ�������Ŀ��ͬ��11.2gFe�����ʵ���Ϊ0.2mol,Feȫ���ܽ�,����Fe2+��Fe3+�����ʵ���֮��Ϊ1:4,��Fe2+�����ʵ���Ϊ0.04mol,Fe3+�����ʵ���Ϊ0.16mol,��ʧȥ����Ϊ0.04mol��2+0.16mol��3=0.56mol���ɵ�ʧ�����غ㣬O2�õ����ӵ����ʵ���Ϊ0.56mol,����O2�����ʵ���Ϊ0.56mol/4=0.14mol����ѡB��
���㾦��
���⿼���������ᷴӦ���йؼ��㣬����Ĺؼ�������ȷ��Ӧԭ���Ļ�����������õ��ӵ�ʧ�غ㡣
�����͡���ѡ��
��������
23
����Ŀ��10mLNO��CO2�Ļ������ͨ��������Na2O2������������Ϊ5mL����ͬ״��������CO2��NO������Ȳ�����Ϊ
A. 1��1 B. 1��2
C. 2��1 D. 3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1���Ȼ�����Һ���ڼ���ʳ���㾫��������ʱ����������ɫ�����������ӽṹ��ͼ��ʾ��
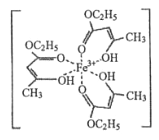
����������У���̬�����ӵļ۵����Ų�ʽΪ________________��
�����������̼ԭ�ӵ��ӻ����������________________��
�����������к��еĻ�ѧ����____________������ĸ����
A. ���Ӽ� B. ������ C. ���Լ� D. �Ǽ��Լ� E. ��λ�� F. ��� G.���� H. ����
���Ȼ����ڳ������ǹ��壬�۵�Ϊ 306�����е�Ϊ 315������ 300������������������ˮ��Ҳ���������ѡ���ͪ���л��ܼ����ݴ��ж��Ȼ����ľ�������Ϊ________________��
��2����̬ A ԭ�ӵļ۵����Ų�ʽΪ 3s23p5��ͭ��A �γɻ�����ľ�����ͼ��ʾ���������ͭԭ�ӣ���
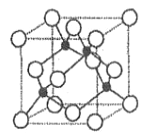
���û�����Ļ�ѧʽΪ________________��Aԭ�ӵ���λ����______________��
���û�����������ˮ���������ڰ�ˮ����ԭ�������________________����NH3 ��Ϊ�ȵ�����ķ�����________________��д��ѧʽ��һ�ּ��ɣ��� NH3 �ļ��Ǵ���H2O�ļ��ǵ���Ҫԭ����_______________________��
����֪�û����ᄃ����ܶ�Ϊ��g��cm-3�������ӵ�������ֵΪ NA����þ����� Cu ԭ�Ӻ�A ԭ��֮�����̾���Ϊ________________pm���г��������ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǹ㷺������ֲ��Ͷ������ڵ���Ȼ�л���������ɽ�(![]() )����é��(
)����é��( )�����ֳ������������й������ֻ������˵������ȷ����
)�����ֳ������������й������ֻ������˵������ȷ����
A. ���ɴ����ϵ�һ�������5��(�����������칹��
B. ���ɴ�����é��һ�������¶��������ᷢ��ȡ����Ӧ
C. �������Ը��������Һ�ɼ��𱡺ɴ�����é��
D. ����������é���ͱ��ɴ���ȫȼ�գ����ɴ����ĵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
(1)��ͼ��N2(g)��H2(g)��Ӧ����1 mol NH3(g)�����������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ��____________________________________________��

(2)��֪��ѧ���������γɻ��1 mol��ѧ���ų������յ���������λkJ��mol��1������֪�������ݣ�
��ѧ�� | HH |
|
����/kJ��mol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N��H�ļ���________kJ��mol��1��
(3)��NH3����ԭNOx���������������������Ⱦ����֪��
4NH3(g)��3O2(g)===2N2(g)��6H2O(g) ��H1����a kJ��mol��1 ��
N2(g)��O2(g)===2NO(g) ��H2����b kJ��mol��1 ��
��1 mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�Ȧ�H3��________ kJ��mol��1(�ú�a��b��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±��ԭ�Ӱ뾶���������еݱ������ȷ���ǣ� ��
A.�����ۡ��е�����
B.��̬�⻯���ȶ�������ǿ
C.±�����ӵĻ�ԭ������ǿ
D.Ԫ�صķǽ���������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ������ڼ���������ϩ����(����)
A.��ˮB.̼������ҺC.�ƾ���ҺD.���Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��һ���¶��·ֽ���������B��C��D��ӦΪ��2A![]() B+2C+3D������������������������ͬ�����H2��15���������A��Ħ��������( )
B+2C+3D������������������������ͬ�����H2��15���������A��Ħ��������( )
A. 30 g/mol B. 60 g/mol
C. 90 g/mol D. 120 g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ����������A��B��C��D��E��F��G��H����������ͼ��ʾת����ϵ������A��FΪ���嵥�ʣ�A�ʻ���ɫ��CΪ����ɫ���廯���BΪ�����г�����Һ�廯����ش��������⣺

��1��д���������ʵĻ�ѧʽ��C________��H______________��
��2�������л�ѧ��Ӧ����ʽ��
��______________________________________��
��______________________________________��
��3��д��D��һ����;__________________________��������D���ڷ����۷�Ӧ�������ڱ��棬������������������A��ʯ���鷴Ӧ�������ڱ�������Ĺ��壬���ڳ�ʪ�����п��Է�Ӧ����D����д����������Ӧ����ʽ_________________��_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com