
【题目】下列有关KOH的说法错误的是
A. 是离子化合物 B. 含有共价键
C. 溶于水后离子键会断裂 D. OH-的电子数、质子数均为10
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 非金属原子间只能形成共价键
B. 非金属原子间不可能形成离子化合物
C. 离子化合物中可能有共价键
D. 共价化合物中可能有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。
Ⅰ.用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH1=a kJ·mol1
②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) ΔH2=b kJ·mol1
③C(s)+O2(g) =CO2(g) ΔH3=c kJ·mol1
则反应C(s)+2NO(g)![]() N2(g)+CO2(g)的ΔH=________。
N2(g)+CO2(g)的ΔH=________。
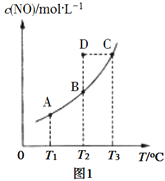
(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g)![]() N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________。
N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________。
A.其他条件不变,改变活性炭的用量,平衡一定不移动
B.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
C.温度为T2时,若反应体系处于状态D,则此时 υ(正)>υ(逆)
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
(3)已知某温度时,反应C(s)+2NO(g)![]() N2(g)+CO2(g)的平衡常数K=
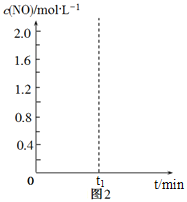
N2(g)+CO2(g)的平衡常数K=![]() ,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_________________
,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_________________
Ⅱ.用纳米铁粉或电解法处理废水中的硝酸盐。
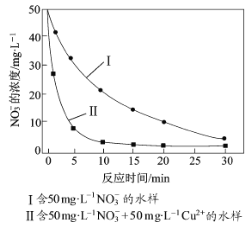
(4)纳米铁粉处理污水中NO3的离子方程式为:4Fe+NO3–+10H+=4Fe2++NH4++3H2O。
实验证实,pH偏低将会导致NO3的去除率下降,其原因是________________。相同条件下,纳米铁粉去除不同水样中NO3的速率有较大差异(见下图),产生该差异的可能原因是________________________。
(5)电解法处理水中硝酸盐的原理是:以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解,产物为N2。请写出阴极的电极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白
族周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
一 | A | |||||||
二 | B | C | ||||||
三 | D | E | F | G | H | I | ||
四 | K | J | ||||||
(1)这11种元素中化学性质最不活泼的是___,金属性最强的是____.(写元素符号)
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)____,离子半径最小的是____,单质氧化性最强的元素是____.(写元素符号)
(3)J的简单离子的结构示意图__.
(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)_____________________.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性____>_____.比较C、G两元素的气态氢化物稳定性____>_____.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为__,它属于____(离子或共价)化合物.
(7)用电子式表示A和G所形成的简单化合物的形成过程__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,下列说法不正确的是
2SO3(g)△H<0,下列说法不正确的是
A. 容器内压强不再变化,说明反应达到平衡状态
B. 当c(SO2):c(O2)=1:2且保持不变,能表明反应达到平衡状态
C. 加入合适的催化剂可显著增大反应速率
D. 达到平衡状态时,相同时间内,每消耗2molSO3的同时生成1molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:

(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石能源的脱硫处理是环保热点问题。
用臭氧处理燃煤烟气脱硫的主要反应如下:![]()
![]() ,向1L反应装置充入
,向1L反应装置充入![]() 和
和![]() ,经过相同反应时间t后剩余
,经过相同反应时间t后剩余![]() 的物质的量与温度关系如图所示:
的物质的量与温度关系如图所示:

已知臭氧会转化成氧气:![]() ,在上述反应条件下臭氧分解率与温度关系如下:
,在上述反应条件下臭氧分解率与温度关系如下:
温度 | 50 | 100 | 150 | 200 | 250 | 300 |
| 0 | 0 | 0 | 4 | 20 | 81 |
![]() 关于脱硫的主要反应,下列说法错误的是______________。
关于脱硫的主要反应,下列说法错误的是______________。
![]() 时,缩小反应装置的体积可以提高相同时间t内
时,缩小反应装置的体积可以提高相同时间t内![]() 的转化率
的转化率
![]() 点该反应处于平衡状态
点该反应处于平衡状态
![]() 随温度的升高,正反应速率变大,逆反应速率减小
随温度的升高,正反应速率变大,逆反应速率减小
![]() 以后随着温度升高,
以后随着温度升高,![]() 的物质的量增多的原因可能是______________________。
的物质的量增多的原因可能是______________________。
![]() 已知
已知![]() 时
时![]() 的平衡常数
的平衡常数![]() ,求该温度下反应
,求该温度下反应![]() 的平衡常数
的平衡常数![]() __________。
__________。
![]() 其他条件不变,经过相同反应时间
其他条件不变,经过相同反应时间![]() ,在图中画出剩余
,在图中画出剩余![]() 的物质的量在
的物质的量在![]() 点温度范围内的关系趋势图____________。
点温度范围内的关系趋势图____________。
![]() 烟气脱硫后续还需用碱液吸收
烟气脱硫后续还需用碱液吸收![]() 形成
形成![]() ,溶液pH为
,溶液pH为![]() 之间时
之间时![]() 在电解池阴极上被还原成连二硫酸根
在电解池阴极上被还原成连二硫酸根![]() ,写出该电极反应式:___________________________。
,写出该电极反应式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com