
【题目】下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白
族周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
一 | A | |||||||
二 | B | C | ||||||
三 | D | E | F | G | H | I | ||
四 | K | J | ||||||
(1)这11种元素中化学性质最不活泼的是___,金属性最强的是____.(写元素符号)
(2)第三周期元素中,原子半径最大的元素是(稀有气体元素除外)____,离子半径最小的是____,单质氧化性最强的元素是____.(写元素符号)
(3)J的简单离子的结构示意图__.
(4)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)_____________________.
(5)比较G、H两元素的最高价氧化物对应水化物的酸性____>_____.比较C、G两元素的气态氢化物稳定性____>_____.(写化学式)
(6)C和D的单质在点燃条件下生成化合物的电子式为__,它属于____(离子或共价)化合物.
(7)用电子式表示A和G所形成的简单化合物的形成过程__.
【答案】Ar K Na Al Cl 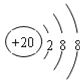 KOH>NaOH>Mg(OH)2>Al(OH)3 HClO4 H2SO4 HCl H2S
KOH>NaOH>Mg(OH)2>Al(OH)3 HClO4 H2SO4 HCl H2S ![]() 离子
离子 ![]()
【解析】
根据元素在元素周期表中的位置判断元素的种类;根据元素周期律分析解答;根据物质的组成及成键方式分析书写电子式和判断化合物类型。
(1)0族元素中化学性质最不活泼,最不活泼的是第三周期的Ar;金属性最强的是左下角元素K;
故答案为:Ar;K;
(2)同周期中,核电荷越小,半径越大,故第三周期中原子半径最大的元素是Na;阳离子有2个电子层,所以离子半径最小的是Al3+;非金属性越强,其单质氧化性越强,所以最强的元素是Cl,
故答案为: Na; Al; Cl ;
(3)J为Ca,其简单离子的结构示意图为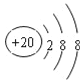 ,
,
故答案为: ;
;
(4)同周期元素,随核电荷数增大,金属性减弱;同主族元素,随核电荷数增大,金属性增强;金属性越强,元素的最高价氧化物对应水化物碱性越强,所以碱性依次减弱顺序为KOH>NaOH>Mg(OH)2>Al(OH)3 ,
故答案为:KOH>NaOH>Mg(OH)2>Al(OH)3 ;
(5)非金属性越强其最高价氧化物对应水化物的酸性越强,氢化物越稳定,所以酸性HClO4> H2SO4,所以稳定性HCl> H2S,
故答案为:HClO4;H2SO4;HCl;H2S;
(6)C和D的单质在点燃条件下生成的化合物为过氧化钠,其电子式为:![]() ;它属于离子化合物,
;它属于离子化合物,
故答案为:![]() ;离子化合物;
;离子化合物;
(7)A和G形成的简单化合物为H2S,其形成过程为:![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。

回答下列问题:
(1)A的电子式是_________;已知C是反式产物,则C的结构简式为_________。
(2)⑥的反应类型是_________,⑧的反应类型是__________。
(3)F含有的官能团的名称是________。
(4)反应⑤的化学方程式为__________。
(5)肉桂酸( )的同分异构体中,含有苯环和碳碳双键,且能够NaHCO3反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有两组峰且面积比为2:3的有机物的结构简式是___________。
)的同分异构体中,含有苯环和碳碳双键,且能够NaHCO3反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有两组峰且面积比为2:3的有机物的结构简式是___________。
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯( )的合成路线___________。
)的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是
A. NaAlO2(aq) AlCl3
AlCl3![]() Al2O3B. NaCl(饱和)
Al2O3B. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3C. N2
Na2CO3C. N2 NO2
NO2![]() HNO3
HNO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
A | C | |
D | B | E |
(1)写出三种元素名称A________、B _______、C_______。
(2)B元素位于元素周期表中第______周期,_______族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸性最强的是(用化学式表示)______。
(4)C原子结构示意图为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 若aXm+核外有10个电子,则a=10-m
B. 因酸性:HCl>H2SO3,元素的非金属性:Cl>S
C. 原子最外层电子数为3的主族元素一定位于第IIIA族
D. 卤化氢均属于强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用锡粒制备氯化锡![]() 和氯化亚锡
和氯化亚锡![]() ,流程如下:
,流程如下:

制备![]() 的装置如图:
的装置如图:

已知:![]() 为无色液体,熔点
为无色液体,熔点![]() ,沸点
,沸点![]() ,遇水强烈水解,可溶于乙醇、四氯化碳等。
,遇水强烈水解,可溶于乙醇、四氯化碳等。![]() 为白色晶体,在空气中加热会发生水解及氧化。
为白色晶体,在空气中加热会发生水解及氧化。![]() 为白色晶体,熔点
为白色晶体,熔点![]() ,沸点
,沸点![]() ,易溶于水、乙醇、冰醋酸,极易溶于盐酸。
,易溶于水、乙醇、冰醋酸,极易溶于盐酸。
请回答:
![]() 步骤
步骤![]() 的反应装置如图甲,其中仪器a的作用为________。若用图乙代替图甲作为反应装置,优点是在不拆除装置的情况下,向支管不断填装锡粒大量制备
的反应装置如图甲,其中仪器a的作用为________。若用图乙代替图甲作为反应装置,优点是在不拆除装置的情况下,向支管不断填装锡粒大量制备![]() ,则制备过程中将生成的
,则制备过程中将生成的![]() 转移至蒸馏烧瓶中的简易操作为________。
转移至蒸馏烧瓶中的简易操作为________。
![]() 步骤
步骤![]() 的装置如图丙,此装置存在一处明显的缺陷为________。
的装置如图丙,此装置存在一处明显的缺陷为________。
![]() 步骤
步骤![]() 选择的实验仪器为铂皿,比用玻璃仪器或陶瓷仪器更好,其理由为________。
选择的实验仪器为铂皿,比用玻璃仪器或陶瓷仪器更好,其理由为________。
![]() 步骤
步骤![]() 中的反应需在搅拌下进行,该反应的化学方程式为________。
中的反应需在搅拌下进行,该反应的化学方程式为________。
![]() 关于
关于![]() 的制备,下列说法不正确的是________。
的制备,下列说法不正确的是________。
A.步骤![]() 蒸发及步骤
蒸发及步骤![]() 干燥时均需在真空环境下进行
干燥时均需在真空环境下进行
B.步骤![]() 抽滤操作中,将晶体转移至布氏漏斗时,若有晶体附着在烧杯内壁,应用蒸馏水将烧杯内壁的晶体淋洗至布氏漏斗中,以提高产率
抽滤操作中,将晶体转移至布氏漏斗时,若有晶体附着在烧杯内壁,应用蒸馏水将烧杯内壁的晶体淋洗至布氏漏斗中,以提高产率
C.为提高产品纯度,可在含醋酸酐的冰醋酸中重结晶
D.![]() 在干燥
在干燥![]() 或干燥HCl气流中加热也可得到无水
或干燥HCl气流中加热也可得到无水![]()
E.若步骤![]() 产生的母液较多,可进一步浓缩母液以提高产品纯度
产生的母液较多,可进一步浓缩母液以提高产品纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。

请回答:
(1)①的反应类型为_________________; J的官能团名称是_______________;
(2)D的化学名称是_________________________, F的结构简式为__________________________。
(3)写出下列反应方程式
①乙醇→A: ________________________________________________________。
② C→D:________________________________________________________。
③B+D→E: _____________________________________________________。
④G→H:________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com