
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验制备乙酸乙酯(如图1):
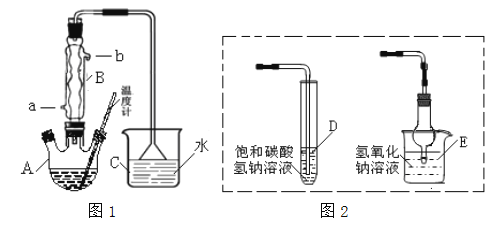
(1)实验时向仪器A中加几块碎石片,其作用是________。 仪器B为冷凝管,冷却水由 ________ (填“a”或“b”)进。
(2)图1方案有明显缺陷,请提出改进建议______________________________。分离乙酸乙酯的操作需要用图3仪器有________(填代号)。
(3)①能否用图2的D装置替代图1的装置C___(填:能或否)。
②能否用图2的E装置替代图1的C装置________ (填:能或否)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料,NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐

(1)NaNO2与食盐的外观相似,易被当成食盐误用,可用食醋、淀粉和KI溶液鉴别。能使混合溶液变蓝的是NaNO2 ,同时产生一种无色气体,该气体遇空气即变为红棕色,该无色气体化学式为___。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,当装置III中反应完全后,接下来的操作是先打开a,再关闭b。则II中可以选用的溶液为_________
A. NaCl B. H2O C. H2SO4 D. NaOH
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,原因可能是_________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗20.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2O)①滴定终点的判断依据为_____
②隔夜熟肉中NaNO2的含量是_____mg/kg(保留三位有效数字)
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等质量的SO2与O2相比较,下列结论正确的是( )
A. 分子个数比为1:1 B. 原子个数比为3:4
C. 氧原子个数比为1:2 D. 体积比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
A.用排水法收集铜粉与浓硝酸反应产生的NO2
B.用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C.用酸性KMnO4溶液验证草酸的还原性
D.用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:

(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖。青蒿素结构简式如图所示。己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”。下列有关青蒿素的说法不正确的是( )
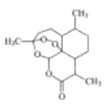
A. 青蒿素分子有6个手性碳原子
B. 青蒿素的化学式为:C15H22O5
C. 青蒿素在一定条件下能与NaOH溶液反应,且有氧化性
D. 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如图所示。
(1)铝热反应是 ________(填“吸热”或“放热”)反应,其能量变化可用下图中的_______(填序号)表示。
反应物的总能量高 | 生成物的总能量高 |
|
|
生成物的总能量低 | 反应物的总能量低 |
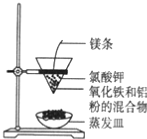
(2)该铝热反应的化学方程式是______________________________________________。
(3)任写出铝热反应在实际生产中的一种用途__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com