
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料,NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐

(1)NaNO2与食盐的外观相似,易被当成食盐误用,可用食醋、淀粉和KI溶液鉴别。能使混合溶液变蓝的是NaNO2 ,同时产生一种无色气体,该气体遇空气即变为红棕色,该无色气体化学式为___。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,当装置III中反应完全后,接下来的操作是先打开a,再关闭b。则II中可以选用的溶液为_________
A. NaCl B. H2O C. H2SO4 D. NaOH
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,原因可能是_________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗20.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2O)①滴定终点的判断依据为_____
②隔夜熟肉中NaNO2的含量是_____mg/kg(保留三位有效数字)
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
【答案】 NO D 2NaNO2+ O2= 2NaNO3 当滴入最后一滴标准液时,锥形瓶内的溶液变红,且在30秒内不褪色。 17.3
【解析】(1)NO是无色气体,易被空气中氧气氧化生成红棕色气体NO2,则此无色气体为NO;
(2)②Ⅰ装置中产生的二氧化氮,与水反应能产生一氧化氮,排到空气中会造成污染,应选择NaOH溶液吸收NO2的尾气,故答案为D;
(3)NaNO2是强碱弱酸盐,溶液呈碱性,在空气中被氧气氧化成NaNO3是强酸强碱盐,所以会使溶液的pH减小,而溶液中NaNO2的含量会减小,反应的方程式为2NaNO2+O2=2NaNO3;
(4)①因为高锰酸钾的稀溶液是红色的,所以滴定终点时,溶液会出现红色,所以滴定终点的判断依据为:(滴入最后一滴标准液时)锥形瓶内溶液变红,且30秒内不褪色;
②根据题意可知,与隔夜熟肉中提取的NaNO2反应的KMnO4的物质的量为0.00500mol/L×0.02L=1.0×10-4mol,根据电子得失守恒可知关系式2KMnO4~5NaNO2,由关系式可知亚硝酸钠的质量为![]() ×1.0×10-4 mol×69g/mol=0.0173g=17.3mg,所以隔夜熟肉中NaNO2的含量为
×1.0×10-4 mol×69g/mol=0.0173g=17.3mg,所以隔夜熟肉中NaNO2的含量为![]() =17.3mg/kg;
=17.3mg/kg;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作或方法中,正确的是( )
A. 海水淡化 ------蒸馏 B. 将碘单质从沙子提取出来--------过滤
C. 盐水中获得食盐--------萃取分液 D. 稀释浓硫酸时将水慢慢加入浓硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于非氧化还原反应的是( )
A. H2SO4+2NaOH=Na2SO4+2H2O
B. 3Cl2+6KOH=5KCl+KClO3+3H2O
C. 3H2O2+2KCrO2+2KOH=2K2CrO4+4H2O
D. 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S +4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(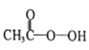 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如下:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃一段时间。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。

不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见下表),请回答相关问题:
反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(1)C仪器中冷水流入口是_____(填a或b),生成过氧乙酸的化学方程式是__________。
(2)反应物最佳比例(CH3COOH/H2O2)是______,反应所需时间约________(选填1、3、5、7)小时。
(3)为更好控制反应温度,应增加的措施是________。
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率。
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d. 0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒。
你选择的试剂及器材是a、________、f、g(选填序号)实验方案是____________。
(5)产品含量测定。
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%KI溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液。该样品中过氧乙酸的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下文,回答问题。
甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分,世界20%的能源需求由它提供。
甲烷是重要的工业原料。甲烷高温分解可得炭黑,常用作颜料、油墨、油漆以及橡胶的添加剂;甲烷还是乙炔、氢氰酸及甲醛等重要物质制备的原料;甲烷还可以制取氯仿(三氯甲烷)和四氯化碳等有机溶剂。
天然气中除甲烷外,另有少量的乙烷、丙烷和丁烷,还有硫化氢、二氧化碳、氮气、水汽和少量一氧化碳等。丙烷俗称“高能气”,2008年北京奥运祥云火炬就是用丙烷作为燃料的。丙烷价格低廉,可燃温度范围宽,燃烧火焰呈亮黄色易识别,燃烧产物无污染。它是一种清洁燃料,特别符合“绿色奥运”的理念。天然气中另一种成分丁烷也有重要用途,可用作冷冻剂和气体打火机燃料,也是制取多种有机物的重要原料。
目前沼气在我国农村也有着广泛的应用。人们在一定的温度、湿度、pH条件下,将秸秆、杂草、人畜粪便等堆积在发酵池中,经隔绝空气发酵产生沼气。现在我国农村通过修建沼气池,不但增加了高效清洁燃料,改善了农村居住环境,而且发酵池中还可以产生优良的液体肥料,一举多得。

(1)天然气中除含甲烷外,还含有______________________________________等有机物。
(2)甲烷高温分解得到炭黑的化学方程式是______________________________________。
(3)氯仿的结构式是______________________________。
(4)北京奥运火炬选择丙烷作气体燃料的原因是______________(填序号)。
a.可燃温度范围宽 b.价格低廉
c.燃烧产物没有污染 d.燃烧的火焰颜色易识别
(5)乙烷与氯气生成一氯乙烷的化学方程式是____________________________________。
(6)下列说法正确的是______________(填序号)。
a.煤矿坑道中严禁明火
b.丁烷可作气体打火机的燃料
c.发酵池中只产生沼气
d.发酵池中可利用的原料有秸秆、杂草、人畜粪便等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠、铝、铁、铜和氧气的反应,不正确的是( )
A. 铁在氧气中燃烧,产物为四氧化三铁
B. 铝表面很容易被氧气氧化,生成致密的氧化物保护膜
C. 钠常温下和氧气反应,生成淡黄色的过氧化钠
D. 铜可以在加热的条件下和氧气反应,生成氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)。下列叙述错误的是( )
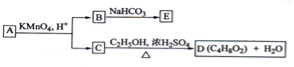
A.B的结构简式为HOOC﹣CH2﹣COOH
B.C与乙醇发生了酯化反应
C.A的结构简式是CH3﹣CH(OH)﹣CH=CH﹣CH3
D.E的分子式为C3H2O4Na2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知:
(1)A 中所含官能团的名称是________。
(2)B 在一定条件下发生聚合反应的化学方程式为________________。
写出同时满足下列条件的B的同分异构体的结构简式__________。
① 核磁共振氢谱有2个吸收峰。② 能发生银镜反应
(3)C→D的化学方程式______________,该转化中涉及到反应类型为________;该反应的副产物中与D 互为同分异构体的化合物的结构简式为___________。
(4)试剂Y的结构简式为______________。
(5)通过常温下的反应,区别E、F和G的试剂是______和_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com