
【题目】下列反应中,属于非氧化还原反应的是( )
A. H2SO4+2NaOH=Na2SO4+2H2O
B. 3Cl2+6KOH=5KCl+KClO3+3H2O
C. 3H2O2+2KCrO2+2KOH=2K2CrO4+4H2O
D. 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S +4H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的离子能在溶液中大量共存的是( )
A. Na+、Mg2+、Cl-、NO3- B. SO42-、Fe2+、K+、OH-
C. Ba2+、Cu2+、SO42-、Cl- D. HCO3-、CO32-、K+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验制备乙酸乙酯(如图1):
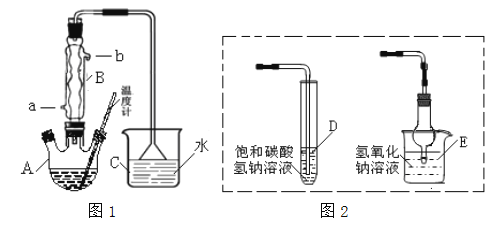
(1)实验时向仪器A中加几块碎石片,其作用是________。 仪器B为冷凝管,冷却水由 ________ (填“a”或“b”)进。
(2)图1方案有明显缺陷,请提出改进建议______________________________。分离乙酸乙酯的操作需要用图3仪器有________(填代号)。
(3)①能否用图2的D装置替代图1的装置C___(填:能或否)。
②能否用图2的E装置替代图1的C装置________ (填:能或否)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2O2的说法中,不正确的是
A. 是浅黄色固体 B. 可用作供氧剂
C. 与H2O反应时,H2O作还原剂 D. 与H2O反应时,放出热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明乙酸是弱酸的事实是
A. 乙酸和水能以任意比例混溶
B. 在稀乙酸水溶液中含有未电离的乙酸分子
C. 乙酸与Na2CO3溶液反应放出CO2气体
D. 1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
(1)在恒温恒压条件下进行,反应正向进行的是________;反应逆向进行的是________;处于平衡状态的是________;无法判断是否达到平衡的是________。
A.单位时间内生成1mol N2,同时生成3mol NH3
B.单位时间内生成3mol N2,同时生成6mol N—H键
C.混合气体的密度不再随时间而改变
D.容器中气体的压强不再随时间而改变
(2)在一定温度下某恒容密闭容器中,充入3molH2和1mol的N2,2min达到平衡状态时,总的气体的物质的量变为原来的9/10,则此时N2的转化率为__________;
若此时放出的热量为18.44 kJ,则其热化学方程式为______________________________ .
根据所求出的热化学方程式,且已知1mol氮氮三键断裂需要为945.8kJ的能量,1mol氢氢键断裂需要436 kJ的能量,求1molN-H键断裂吸收的能量_____。
(3)氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,
则氨燃料电池的负极电极反应为________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料,NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐

(1)NaNO2与食盐的外观相似,易被当成食盐误用,可用食醋、淀粉和KI溶液鉴别。能使混合溶液变蓝的是NaNO2 ,同时产生一种无色气体,该气体遇空气即变为红棕色,该无色气体化学式为___。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,当装置III中反应完全后,接下来的操作是先打开a,再关闭b。则II中可以选用的溶液为_________
A. NaCl B. H2O C. H2SO4 D. NaOH
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,原因可能是_________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗20.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2O)①滴定终点的判断依据为_____
②隔夜熟肉中NaNO2的含量是_____mg/kg(保留三位有效数字)
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖。青蒿素结构简式如图所示。己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”。下列有关青蒿素的说法不正确的是( )
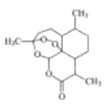
A. 青蒿素分子有6个手性碳原子
B. 青蒿素的化学式为:C15H22O5
C. 青蒿素在一定条件下能与NaOH溶液反应,且有氧化性
D. 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com