
【题目】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知:
(1)A 中所含官能团的名称是________。
(2)B 在一定条件下发生聚合反应的化学方程式为________________。
写出同时满足下列条件的B的同分异构体的结构简式__________。
① 核磁共振氢谱有2个吸收峰。② 能发生银镜反应
(3)C→D的化学方程式______________,该转化中涉及到反应类型为________;该反应的副产物中与D 互为同分异构体的化合物的结构简式为___________。
(4)试剂Y的结构简式为______________。
(5)通过常温下的反应,区别E、F和G的试剂是______和_______。
【答案】 羧基、羰基 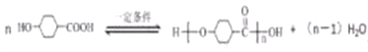

 消去和中和反应
消去和中和反应 ![]() CH3MgBr Na NaHCO3
CH3MgBr Na NaHCO3
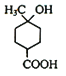
【解析】由A、B的结构可知反应①为A与氢气发生加成反应生成B,B与HBr发生取代反应生成C为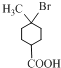 ,C发生消去反应生成D为
,C发生消去反应生成D为![]() ,D水解反应得到E为
,D水解反应得到E为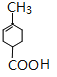 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为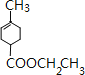 ,F发生信息反应生成G为,结合F与G的结合可知Y为CH3MgBr;
,F发生信息反应生成G为,结合F与G的结合可知Y为CH3MgBr;
(1)由有机物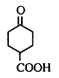 的结构可知,A中含有羰基、羧基;
的结构可知,A中含有羰基、羧基;
(2) 在一定条件下发生缩聚反应的化学方程式为
在一定条件下发生缩聚反应的化学方程式为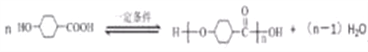 ;B的同分异构体中,核磁共振氢谱有2个吸收峰,说明分子中含有2种H原子,由B的结构可知,分子中H原子数目很多,故该同分异构体为对称结构,为链状不饱和度为2,能发生银镜反应,故含有醛基2个-CHO,其余的H原子以甲基形式存在,另外的O原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为:
;B的同分异构体中,核磁共振氢谱有2个吸收峰,说明分子中含有2种H原子,由B的结构可知,分子中H原子数目很多,故该同分异构体为对称结构,为链状不饱和度为2,能发生银镜反应,故含有醛基2个-CHO,其余的H原子以甲基形式存在,另外的O原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为: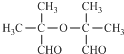 ;
;
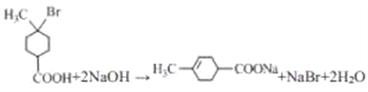
(3)由上面的分析可知,C→D的反应方程式为 +2NaOH
+2NaOH![]()
![]() +NaBr+2H2O,,该转化中涉及到反应类型为消去和中和反应;因消去HBr的可能有两种,则该反应的副产物中与D 互为同分异构体的化合物的结构简式为
+NaBr+2H2O,,该转化中涉及到反应类型为消去和中和反应;因消去HBr的可能有两种,则该反应的副产物中与D 互为同分异构体的化合物的结构简式为![]() ;
;
(4)结合G的结构与反应信息可知,试剂Y为CH3MgBr;
(5) 只有酯基,可用Na与
只有酯基,可用Na与 、
、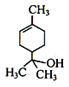 区别开来,羧基能和碳酸氢钠反应、醇羟基和NaHCO3溶液不反应,现象不同,故选择NaHCO3来鉴别
区别开来,羧基能和碳酸氢钠反应、醇羟基和NaHCO3溶液不反应,现象不同,故选择NaHCO3来鉴别 与
与 ,故选用的试剂为Na和NaHCO3。
,故选用的试剂为Na和NaHCO3。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料,NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30mg/kg。
活动二:鉴别NaNO2与食盐

(1)NaNO2与食盐的外观相似,易被当成食盐误用,可用食醋、淀粉和KI溶液鉴别。能使混合溶液变蓝的是NaNO2 ,同时产生一种无色气体,该气体遇空气即变为红棕色,该无色气体化学式为___。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置示意图如下,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,当装置III中反应完全后,接下来的操作是先打开a,再关闭b。则II中可以选用的溶液为_________
A. NaCl B. H2O C. H2SO4 D. NaOH
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,原因可能是_________(用化学方程式解释)。
活动四:检测熟肉中NaNO2含量的变化
(4)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO3与NaNO2后,配成溶液,再分别用0.00500mol/L的高锰酸钾(酸性)溶液滴定,刚煮熟的肉消耗12.00mL,隔夜肉消耗20.00mL,(已知:2MnO4一+5 NO2一+6H+=2 Mn2++5NO3一+3 H2O)①滴定终点的判断依据为_____
②隔夜熟肉中NaNO2的含量是_____mg/kg(保留三位有效数字)
活动五:综合其它实验和查阅资料获知,熟肉在细菌等作用下,NaNO3部分转化为NaNO2但只要保存得当,隔夜仍可食用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖。青蒿素结构简式如图所示。己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”。下列有关青蒿素的说法不正确的是( )
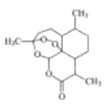
A. 青蒿素分子有6个手性碳原子
B. 青蒿素的化学式为:C15H22O5
C. 青蒿素在一定条件下能与NaOH溶液反应,且有氧化性
D. 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指
A. 乙烯B. 脱落酸C. 生长素D. 甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,所得溶液中Fe3+和Fe2+物质的量浓度之比为1:3,则已反应的Fe3+与未反应的Fe3+的物质的量之比是( )
A. 1:1 B. 3:2 C. 2:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质的分类正确的是( )
A.水玻璃属于纯净物
B.SiO2、烧碱、明矾分别为酸性氧化物、碱、盐
C.Cu、NaCl、HCl、氯水均为电解质
D.CaO、Na2O、Na2O2均属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如图所示。
(1)铝热反应是 ________(填“吸热”或“放热”)反应,其能量变化可用下图中的_______(填序号)表示。
反应物的总能量高 | 生成物的总能量高 |
|
|
生成物的总能量低 | 反应物的总能量低 |
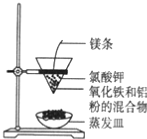
(2)该铝热反应的化学方程式是______________________________________________。
(3)任写出铝热反应在实际生产中的一种用途__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出B元素在周期表中的位置为______,属于___区元素,A2+在基态时价电子排布图为__________________。
(2)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。水分子中心原子价层电子对数为____,二氧化碳的VSEPR模型为______,苯分子中碳原子的杂化类型为________。
(3)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等。铑(Rh)与钴属于同族元素,某些性质相似。现有铑的某盐组成为CsRh(SO4)2·4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成。该盐中铑离子的配位数为____。请写出该盐溶解于水后的电离方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下电离方程式错误的是
A. NaOH=Na++OH- B. Fe2(SO4)3=2Fe3++3SO42-
C. MgCl2=Mg2++2Cl- D. NaHCO3=Na++H++CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com