
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,所得溶液中Fe3+和Fe2+物质的量浓度之比为1:3,则已反应的Fe3+与未反应的Fe3+的物质的量之比是( )
A. 1:1 B. 3:2 C. 2:1 D. 2:3
科目:高中化学 来源: 题型:
【题目】阅读下文,回答问题。
甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分,世界20%的能源需求由它提供。
甲烷是重要的工业原料。甲烷高温分解可得炭黑,常用作颜料、油墨、油漆以及橡胶的添加剂;甲烷还是乙炔、氢氰酸及甲醛等重要物质制备的原料;甲烷还可以制取氯仿(三氯甲烷)和四氯化碳等有机溶剂。
天然气中除甲烷外,另有少量的乙烷、丙烷和丁烷,还有硫化氢、二氧化碳、氮气、水汽和少量一氧化碳等。丙烷俗称“高能气”,2008年北京奥运祥云火炬就是用丙烷作为燃料的。丙烷价格低廉,可燃温度范围宽,燃烧火焰呈亮黄色易识别,燃烧产物无污染。它是一种清洁燃料,特别符合“绿色奥运”的理念。天然气中另一种成分丁烷也有重要用途,可用作冷冻剂和气体打火机燃料,也是制取多种有机物的重要原料。
目前沼气在我国农村也有着广泛的应用。人们在一定的温度、湿度、pH条件下,将秸秆、杂草、人畜粪便等堆积在发酵池中,经隔绝空气发酵产生沼气。现在我国农村通过修建沼气池,不但增加了高效清洁燃料,改善了农村居住环境,而且发酵池中还可以产生优良的液体肥料,一举多得。

(1)天然气中除含甲烷外,还含有______________________________________等有机物。
(2)甲烷高温分解得到炭黑的化学方程式是______________________________________。
(3)氯仿的结构式是______________________________。
(4)北京奥运火炬选择丙烷作气体燃料的原因是______________(填序号)。
a.可燃温度范围宽 b.价格低廉
c.燃烧产物没有污染 d.燃烧的火焰颜色易识别
(5)乙烷与氯气生成一氯乙烷的化学方程式是____________________________________。
(6)下列说法正确的是______________(填序号)。
a.煤矿坑道中严禁明火
b.丁烷可作气体打火机的燃料
c.发酵池中只产生沼气
d.发酵池中可利用的原料有秸秆、杂草、人畜粪便等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。

(1)其负极是_________(填“Zn”或“Cu”),发生的是__________(填“氧化”或“还原”)反应。
(2)正极上的现象是________________________________________。
(3)电子由_______________(填“锌片”或“铜片”)沿导线流出。
(4)电池的总反应是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池一种新型环保的发电装置,用氢氧化钾做电解质溶液。
(1)氢氧燃料电池的能量转化的主要形式是________________,
(2)正极反应式为____________________。总反应式为____________________。
(3)氢氧燃料电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O===LiOH+H2↑
2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的氧化剂是________,反应Ⅱ中的还原剂是________。
②已知LiH固体密度为0.8 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为90%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A.H2S、O2、N2
B.HCl、Cl2、CO2
C.N2、H2、CO
D.SO2、Cl2、O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知:
(1)A 中所含官能团的名称是________。
(2)B 在一定条件下发生聚合反应的化学方程式为________________。
写出同时满足下列条件的B的同分异构体的结构简式__________。
① 核磁共振氢谱有2个吸收峰。② 能发生银镜反应
(3)C→D的化学方程式______________,该转化中涉及到反应类型为________;该反应的副产物中与D 互为同分异构体的化合物的结构简式为___________。
(4)试剂Y的结构简式为______________。
(5)通过常温下的反应,区别E、F和G的试剂是______和_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布图是 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l) =3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(3)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
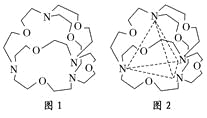
下列分子或离子中,能被该有机化合物识别的是________(填标号)。
a.CF4 b.CH4c.NH4+d.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
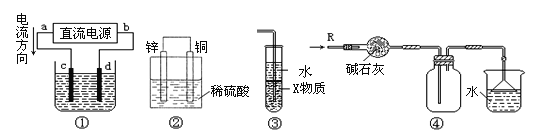
A. 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B. 装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C. 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com