
【题目】某原电池装置如图所示。

(1)其负极是_________(填“Zn”或“Cu”),发生的是__________(填“氧化”或“还原”)反应。
(2)正极上的现象是________________________________________。
(3)电子由_______________(填“锌片”或“铜片”)沿导线流出。
(4)电池的总反应是_______________________________________。
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】可以证明乙酸是弱酸的事实是
A. 乙酸和水能以任意比例混溶
B. 在稀乙酸水溶液中含有未电离的乙酸分子
C. 乙酸与Na2CO3溶液反应放出CO2气体
D. 1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等质量的SO2与O2相比较,下列结论正确的是( )
A. 分子个数比为1:1 B. 原子个数比为3:4
C. 氧原子个数比为1:2 D. 体积比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:

(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)是提炼铅及其化合物的重要矿物,其工艺流程如下:

回答下列问题:
(1)流程中“趁热”过滤的原因是_____________,滤渣的主要成分是_________________。
(2)该工艺流程中可循环利用的物质是__________________。
(3)PbSO4与PbS在加热条件下发生反应的化学方程式为_____________________。
(4)《药性论》中有关铅丹(Pb3O4)的描述是:“治惊悸狂走,呕逆,消渴。”将PbO高温焙烧可制得铅丹,铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,提纯时发生反应的离子方程是_______________。
(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,电解过程中阳极的电极反应式为____________;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池负极增重_____g。
(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中 =__________。(已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36)
=__________。(已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖。青蒿素结构简式如图所示。己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”。下列有关青蒿素的说法不正确的是( )
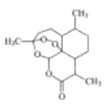
A. 青蒿素分子有6个手性碳原子
B. 青蒿素的化学式为:C15H22O5
C. 青蒿素在一定条件下能与NaOH溶液反应,且有氧化性
D. 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物应用广泛。
Ⅰ.氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下:

已知:CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易氧化。
回答下列问题:
(1)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。
(2)步骤③中 (NH4)2SO3要适当过量,目的是使Cu2+充分还原速率和________,其主要反应的离子方程式为_________。已知NH4Cl、Cu2+的物质的量之比[n( NH4Cl )/n(Cu2+)]与Cu2+沉淀率的关系如右图所示,当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,原因是________。

Ⅱ.以氧缺位铁酸铜(CuFe2O4-x)作催化剂,可利用太阳能热化学循环法分解H2O制H2,其物质转化如图甲所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为________。
②若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为________L。(标准状况下)
③CuFe2O4可用电化学方法得到,其原理如图乙所示,则阳极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,所得溶液中Fe3+和Fe2+物质的量浓度之比为1:3,则已反应的Fe3+与未反应的Fe3+的物质的量之比是( )
A. 1:1 B. 3:2 C. 2:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室利用质子酸甲醇燃料电池作电源,电解硫酸铜溶液。

请回答下列问题:
(1)通入氧气的电极为______(填“正极”或“负极”),通入甲醇一极的电极反应式为_________。
(2)b电极上的现象为________________。
(3)假设硫酸铜溶液的体积为600 mL(电解前后溶液的体积变化忽略不计),若消耗336 mL(标准状况)O2,则电解后硫酸铜溶液的pH为________。
(4)若a、b均换成铜电极,则电解一段时间后硫酸铜溶液的浓度________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com