
【题目】铜及其化合物应用广泛。
Ⅰ.氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下:

已知:CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易氧化。
回答下列问题:
(1)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。
(2)步骤③中 (NH4)2SO3要适当过量,目的是使Cu2+充分还原速率和________,其主要反应的离子方程式为_________。已知NH4Cl、Cu2+的物质的量之比[n( NH4Cl )/n(Cu2+)]与Cu2+沉淀率的关系如右图所示,当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,原因是________。

Ⅱ.以氧缺位铁酸铜(CuFe2O4-x)作催化剂,可利用太阳能热化学循环法分解H2O制H2,其物质转化如图甲所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为________。
②若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为________L。(标准状况下)
③CuFe2O4可用电化学方法得到,其原理如图乙所示,则阳极的电极反应式为__________。
【答案】 4Cu+NO3- +10H+ = 4Cu2+ + NH4++3H2O 防止CuCl被空气氧化 2Cu2+ + SO32- + 2Cl-+ H2O = 2CuCl↓+ SO42-+ 2H+ 生成的氯化亚铜又溶解于氯化铵溶液中 CuFe2O4-x+xH2O= CuFe2O4+xH2 3.36 Cu+2Fe+4O2—8e-=CuFe2O4
【解析】Ⅰ.(1)步骤①中N元素被还原为最低价即-3价,则Cu溶解的离子方程式为4Cu+NO3- +10H+ = 4Cu2+ + NH4++3H2O;化学方程式为4Cu+NH4NO3 +5H2SO4= 4CuSO4 + (NH4)2SO4+3H2O;(2)步骤③中 (NH4)2SO3要适当过量,目的是保证使Cu2+充分还原的速率;防止CuCl被空气氧化;主要反应是铜离子与亚硫酸铵发生氧化还原反应生成CuCl,其离子方程式为2Cu2+ + SO32- + 2Cl-+ H2O = 2CuCl↓+ SO42-+ 2H+;当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,原因是生成的氯化亚铜又溶解于氯化铵溶液中。
Ⅱ. ①根据图中信息可知,氧缺位铁酸铜(CuFe2O4-x)与水反应生成CuFe2O4和氢气,其化学方程式为:CuFe2O4-x+xH2O= CuFe2O4+xH2;②根据化学方程式CuFe2O4-x+xH2O= CuFe2O4+xH2,若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为0.15mol×22.4L/mol=3.36L;③根据电化学方法制得CuFe2O4的原理图可知,阳极铜铁合金熔融状态下失去电子与氧离子反应,电极反应式为:Cu+2Fe+4O2- -8e-=CuFe2O4。


科目:高中化学 来源: 题型:
【题目】已知在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+、Sn2++2Fe3+=2Fe2++Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A. Sn2+、Fe2+、Ce3+ B. Sn2+、Ce3+、Fe2+
C. Ce3+、Fe2+、Sn2+ D. Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
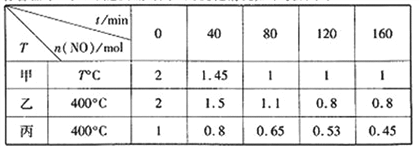
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa
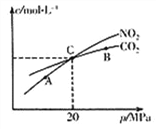 (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为_______________________。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
实验测得NH4HSO3溶液中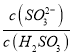 =15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时,
=15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时, 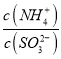 =________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。

(1)其负极是_________(填“Zn”或“Cu”),发生的是__________(填“氧化”或“还原”)反应。
(2)正极上的现象是________________________________________。
(3)电子由_______________(填“锌片”或“铜片”)沿导线流出。
(4)电池的总反应是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如下图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是

A. H2SO3的Ka1=1×10-2
B. 0.05mol/L NaHSO3溶液的PH=4.25
C. 图中Y点对应的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 图中Z点对应的溶液中:c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池一种新型环保的发电装置,用氢氧化钾做电解质溶液。
(1)氢氧燃料电池的能量转化的主要形式是________________,
(2)正极反应式为____________________。总反应式为____________________。
(3)氢氧燃料电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O===LiOH+H2↑
2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的氧化剂是________,反应Ⅱ中的还原剂是________。
②已知LiH固体密度为0.8 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为90%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A.H2S、O2、N2
B.HCl、Cl2、CO2
C.N2、H2、CO
D.SO2、Cl2、O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝的熔点很高,常用于制造耐火材料,例如制作耐火坩埚。下列操作不能在氧化铝坩埚中进行的是( )
A. 加热使CuSO4·5H2O失水 B. 加热使KMnO4分解
C. 加热熔化烧碱 D. 加热分解碱式碳酸铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com