
【题目】标准状况下,等质量的SO2与O2相比较,下列结论正确的是( )
A. 分子个数比为1:1 B. 原子个数比为3:4
C. 氧原子个数比为1:2 D. 体积比为2:1
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】(1)在有机物 ①![]() ;② CH2=CH2;③CH≡CH;④
;② CH2=CH2;③CH≡CH;④![]() ;⑤
;⑤![]() ;
;
⑥![]() ;⑦ CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是__________。 (填写上述物质的序号)
;⑦ CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是__________。 (填写上述物质的序号)
(2)![]() 的系统命名为:________________________
的系统命名为:________________________
(3)现有下列A、B两组物质:
A组:CH3—CHCl—CH3、![]() 、HCOOH、 ④CH3COOC2H5。
、HCOOH、 ④CH3COOC2H5。
B组:CH3CH2CH2OH、银氨溶液、KOH溶液、④Na2CO3溶液。
A组中____________能跟B组中所有物质都可发生反应。(填写上述物质的序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+、Sn2++2Fe3+=2Fe2++Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A. Sn2+、Fe2+、Ce3+ B. Sn2+、Ce3+、Fe2+
C. Ce3+、Fe2+、Sn2+ D. Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下文,回答问题。
甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分,世界20%的能源需求由它提供。
甲烷是重要的工业原料。甲烷高温分解可得炭黑,常用作颜料、油墨、油漆以及橡胶的添加剂;甲烷还是乙炔、氢氰酸及甲醛等重要物质制备的原料;甲烷还可以制取氯仿(三氯甲烷)和四氯化碳等有机溶剂。
天然气中除甲烷外,另有少量的乙烷、丙烷和丁烷,还有硫化氢、二氧化碳、氮气、水汽和少量一氧化碳等。丙烷俗称“高能气”,2008年北京奥运祥云火炬就是用丙烷作为燃料的。丙烷价格低廉,可燃温度范围宽,燃烧火焰呈亮黄色易识别,燃烧产物无污染。它是一种清洁燃料,特别符合“绿色奥运”的理念。天然气中另一种成分丁烷也有重要用途,可用作冷冻剂和气体打火机燃料,也是制取多种有机物的重要原料。
目前沼气在我国农村也有着广泛的应用。人们在一定的温度、湿度、pH条件下,将秸秆、杂草、人畜粪便等堆积在发酵池中,经隔绝空气发酵产生沼气。现在我国农村通过修建沼气池,不但增加了高效清洁燃料,改善了农村居住环境,而且发酵池中还可以产生优良的液体肥料,一举多得。

(1)天然气中除含甲烷外,还含有______________________________________等有机物。
(2)甲烷高温分解得到炭黑的化学方程式是______________________________________。
(3)氯仿的结构式是______________________________。
(4)北京奥运火炬选择丙烷作气体燃料的原因是______________(填序号)。
a.可燃温度范围宽 b.价格低廉
c.燃烧产物没有污染 d.燃烧的火焰颜色易识别
(5)乙烷与氯气生成一氯乙烷的化学方程式是____________________________________。
(6)下列说法正确的是______________(填序号)。
a.煤矿坑道中严禁明火
b.丁烷可作气体打火机的燃料
c.发酵池中只产生沼气
d.发酵池中可利用的原料有秸秆、杂草、人畜粪便等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
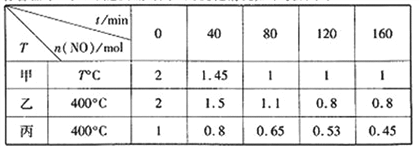
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa
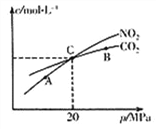 (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为_______________________。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
实验测得NH4HSO3溶液中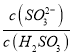 =15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时,
=15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时, 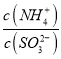 =________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。

(1)其负极是_________(填“Zn”或“Cu”),发生的是__________(填“氧化”或“还原”)反应。
(2)正极上的现象是________________________________________。
(3)电子由_______________(填“锌片”或“铜片”)沿导线流出。
(4)电池的总反应是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com