
【题目】方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)是提炼铅及其化合物的重要矿物,其工艺流程如下:

回答下列问题:
(1)流程中“趁热”过滤的原因是_____________,滤渣的主要成分是_________________。
(2)该工艺流程中可循环利用的物质是__________________。
(3)PbSO4与PbS在加热条件下发生反应的化学方程式为_____________________。
(4)《药性论》中有关铅丹(Pb3O4)的描述是:“治惊悸狂走,呕逆,消渴。”将PbO高温焙烧可制得铅丹,铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,提纯时发生反应的离子方程是_______________。
(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,电解过程中阳极的电极反应式为____________;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池负极增重_____g。
(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中 =__________。(已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36)
=__________。(已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36)
【答案】 防止PbCl2结晶析出 Ag和Fe(OH)3 盐酸 PbS+PbSO4![]() 2Pb+2SO2 PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-) Pb2++2H2O-2e-=PbO2+4H+ 9.6 2.6×108
2Pb+2SO2 PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-) Pb2++2H2O-2e-=PbO2+4H+ 9.6 2.6×108
【解析】盐酸酸浸:PbS+2HCl=PbCl2+H2S↑,ZnS+2HCl=ZnCl2+H2S↑,Fe+2HCl=FeCl2+H2↑,通入适量Cl2:2FeCl2+Cl2=2FeCl3,调节PH=3.7,Fe3++3H2O![]() Fe(OH)3+3H+ ,加热,趁热过滤,滤渣为Ag和Fe(OH)3 ,滤液中含PbCl2和ZnCl2,冰水冷却,得PbCl2晶体,加H2SO4,H2SO4+PbCl2=PbSO4↓+2HCl,最后PbS和PbSO4混合加热,PbS+PbSO4
Fe(OH)3+3H+ ,加热,趁热过滤,滤渣为Ag和Fe(OH)3 ,滤液中含PbCl2和ZnCl2,冰水冷却,得PbCl2晶体,加H2SO4,H2SO4+PbCl2=PbSO4↓+2HCl,最后PbS和PbSO4混合加热,PbS+PbSO4![]() 2Pb+2SO2
2Pb+2SO2
(1)流程中“趁热”过滤的原因是防止PbCl2结晶析出,增加产率;滤渣的主要成分是滤渣为Ag和Fe(OH)3 ;(2)该工艺流程中,一开始盐酸是原料,H2SO4+PbCl2=PbSO4↓+2HCl,生成HCl ,可循环利用的物质是HCl;(3)PbSO4与PbS在加热条件下发生反应的化学方程式为PbS+PbSO4![]() 2Pb+2SO2;(4)铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,说明PbO具有两性,提纯时发生反应的离子方程是PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-);(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,Pb2+ 失电子被氧化,在阳极发生氧化,电解过程中阳极的电极反应式为Pb2++2H2O-2e-=PbO2+4H+ ;由电解装置中阳极Pb2++2H2O-2e-=PbO2+4H+ 增重23.9g,即生成PbO2的物质的量23.9g/239g·mol-1=0.1mol,转移电子0.2mol,蓄电池负极反应式:Pb- 2e- + SO42- PbSO4↓,增重0.1molSO42―,增重9.6g;(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中
2Pb+2SO2;(4)铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,说明PbO具有两性,提纯时发生反应的离子方程是PbO+OH-+H2O=[Pb(OH)3]-(或[Pb(OH)4]2-);(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,Pb2+ 失电子被氧化,在阳极发生氧化,电解过程中阳极的电极反应式为Pb2++2H2O-2e-=PbO2+4H+ ;由电解装置中阳极Pb2++2H2O-2e-=PbO2+4H+ 增重23.9g,即生成PbO2的物质的量23.9g/239g·mol-1=0.1mol,转移电子0.2mol,蓄电池负极反应式:Pb- 2e- + SO42- PbSO4↓,增重0.1molSO42―,增重9.6g;(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中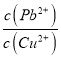 =
=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:
4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) ΔH=-115.6 kJ/mol
2Cl2(g) + 2H2O(g) ΔH=-115.6 kJ/mol
恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是
A. 氯化氢的转化率不再改变 B. 气体的质量不再改变
C. 断开4 mol H-Cl键的同时生成4 mol H-O键 D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
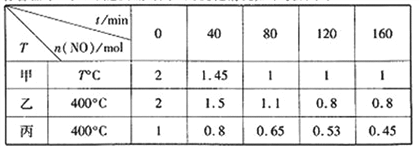
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa
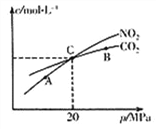 (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为_______________________。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
实验测得NH4HSO3溶液中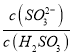 =15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时,
=15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时, 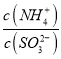 =________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A. ①②③B. ①②③④
C. ①②③④⑤D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。

(1)其负极是_________(填“Zn”或“Cu”),发生的是__________(填“氧化”或“还原”)反应。
(2)正极上的现象是________________________________________。
(3)电子由_______________(填“锌片”或“铜片”)沿导线流出。
(4)电池的总反应是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如下图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是

A. H2SO3的Ka1=1×10-2
B. 0.05mol/L NaHSO3溶液的PH=4.25
C. 图中Y点对应的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 图中Z点对应的溶液中:c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A.H2S、O2、N2
B.HCl、Cl2、CO2
C.N2、H2、CO
D.SO2、Cl2、O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )

A. 此反应的化学方程式为2M = N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com