
【题目】据凤凰网2018 年2 月1日报道:中科院研发出世界最强氘氚中子源,下列有关说法正确的是
A. 氘、氚是两种不同的元素 B. 氘、氚的中子数分别为1、2
C. 氘、氚核外电子数不同 D. 中子带正电
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为______。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为______(填元素符号),其原因为__________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为______;1 mol B2A4分子中含______ mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为______,乙为______;高温时,甲易转化为乙的原因为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应C(s)+CO2(g)=2CO(g),下列措施能使其反应速率减小的是
A. 适当减少木炭的量 B. 将木炭块变为木炭粉
C. 加热反应物 D. 扩大反应容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C三种短周期元素。A—离子的电子层结构和氖原子相同;短周期元素中B的最高价氧化物对应的水化物碱性最强;C的最外层电子数是其内层电子数的3倍。试推断:
(1)这三种元素分别是:A______、B______、C______;(用元素符号表示)
(2)请写出A—的离子结构示意图__________;
(3)B与C形成的化合物B2C2中含有的化学键类型有_______________;
(4)B元素的最高价氧化物对应的水化物与足量硫酸溶液反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。
Ⅰ.用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH1=a kJ·mol1
②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) ΔH2=b kJ·mol1
③C(s)+O2(g) =CO2(g) ΔH3=c kJ·mol1
则反应C(s)+2NO(g)![]() N2(g)+CO2(g)的ΔH=________。
N2(g)+CO2(g)的ΔH=________。
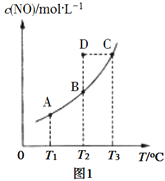
(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g)![]() N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________。
N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________。
A.其他条件不变,改变活性炭的用量,平衡一定不移动
B.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
C.温度为T2时,若反应体系处于状态D,则此时 υ(正)>υ(逆)
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
(3)已知某温度时,反应C(s)+2NO(g)![]() N2(g)+CO2(g)的平衡常数K=
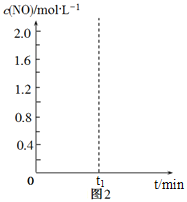
N2(g)+CO2(g)的平衡常数K=![]() ,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_________________
,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_________________
Ⅱ.用纳米铁粉或电解法处理废水中的硝酸盐。
(4)纳米铁粉处理污水中NO3的离子方程式为:4Fe+NO3–+10H+=4Fe2++NH4++3H2O。
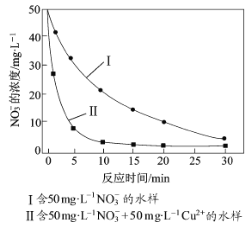
实验证实,pH偏低将会导致NO3的去除率下降,其原因是________________。相同条件下,纳米铁粉去除不同水样中NO3的速率有较大差异(见下图),产生该差异的可能原因是________________________。
(5)电解法处理水中硝酸盐的原理是:以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解,产物为N2。请写出阴极的电极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的认识正确的是
A. 第IA 族元素又可称为碱金属元素 B. 每一族只有一列
C. 0 族元素的原子最外层均有8 个电子 D. 前3 个周期为短周期、其余为长周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,下列说法不正确的是
2SO3(g)△H<0,下列说法不正确的是
A. 容器内压强不再变化,说明反应达到平衡状态
B. 当c(SO2):c(O2)=1:2且保持不变,能表明反应达到平衡状态
C. 加入合适的催化剂可显著增大反应速率
D. 达到平衡状态时,相同时间内,每消耗2molSO3的同时生成1molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
(1)请画出元素⑨阴离子的结构示意图:________________________________。
(2)③⑤⑧的原子半径由小到大的顺序为________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为______>______(填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为__________。
(5)用电子式表示⑥和⑨形成的化合物的过程:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com