
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸钠粉末,pH增大,溶液漂白性减弱
D. 光照过程中,有气泡冒出,溶液的导电性增强
【答案】D
【解析】
A.氯气溶于水达到平衡后,再通入少量氯气,由于此时已经为饱和溶液,所以氢离子和次氯酸根离子的比值不变,故A错误;
B.氯气和二氧化硫在水溶液中会发生反应生成硫酸和盐酸,硫酸与盐酸不具有漂白性,因此反应后的溶液漂白性会逐渐减弱甚至消失,B错误;
C.加入少量的碳酸钠粉末,Na2CO3与溶液中的HCl发生反应,溶液中c(H+)降低,使Cl2+H2OHCl+HClO向正向移动,当达到平衡后,溶液中氢离子浓度减小,次氯酸浓度增加,pH增大,溶液漂白性增强,C错误;
D.光照下,次氯酸易分解为盐酸和氧气,有气泡冒出,HClO分解使平衡Cl2+H2OHCl+HClO向正向移动,最终导致溶液中离子浓度增大,溶液的导电性会增强,D正确;
答案选D。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科
(1)从氯化钾溶液中得到氯化钾固体,常用的方法是______________。
(2)从碘水中分离出碘,实验方法的名称为____________,该方法主要实验仪器是____。
(3)现有A、B两种有机物的液态混合物,如果A、B互溶,且相互不发生化学反应,在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题:
①分离上述A、B的混合物,常用的方法是______;
②如图是某同学设计的分离A、B混合物的操作示意图,请在其冷凝管处标上进出水方向(用箭头↑表示)______;蒸馏烧瓶内碎瓷片的作用是______。
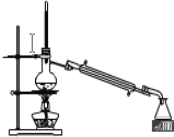
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A. 低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
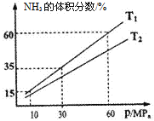
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp_______(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留3位小数)。
②T1_____________T2(填“>”、“<”或“=”)。
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g) ![]() 2N*;H2(g)
2N*;H2(g) ![]() 2H*(慢反应)
2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H*
NH*;NH*+H* ![]() NH2*;NH2* +H*
NH2*;NH2* +H* ![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
(5)肼(N2H4)又称为联氨,可作火箭发动机的燃料。肼分子的电子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液 ②含有泥沙的食盐水 ③溶有碘(I2)的碘化钾溶液 ④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是 ( )
(1)![]() (2)
(2)![]() (3)
(3)![]() (4)
(4)![]()
A.①-(3)-分液B.②-(2)-过滤
C.③-(2)-萃取D.④-(1)-蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为 _____基态铝原子核外电子云形状有_________(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中α键和![]() 键的个数比为_____,分子中碳原子轨道的杂化类型是___
键的个数比为_____,分子中碳原子轨道的杂化类型是___
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由
采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由![]() 转变为
转变为![]() 晶体体积_____(填“膨胀”或“收缩”)。
晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a pm,该晶体的密度为__gcm﹣3.
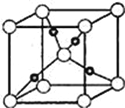
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是
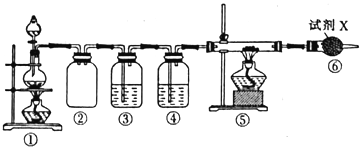
A. ①中发生的化学反应为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
B. ④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C. ③中盛放的试剂是NaOH 溶液
D. 实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: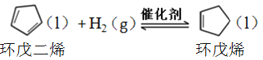 ,
,![]()
副反应: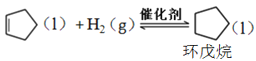 ,
,![]()
解聚反应: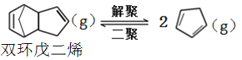 ,
,![]()
回答下列问题:
(1)反应![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
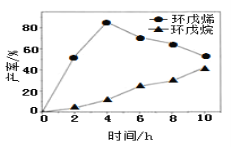
①0~4h氢化反应速率比副反应快的可能原因是_________。
②最佳的反应时间为__h。若需迅速减慢甚至停止反应,可采取的措施有____(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是 ____(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯醚是一种麻醉剂,其合成路线如图,有关说法正确的是( )
![]()
A. X可能是Br2B. X可能为HO﹣Cl
C. 乙烯醚易溶于水D. ①②③反应类型依次为取代、取代和消去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com