
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: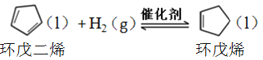 ,
,![]()
副反应: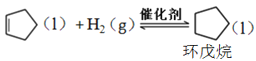 ,
,![]()
解聚反应: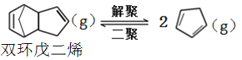 ,
,![]()
回答下列问题:
(1)反应![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
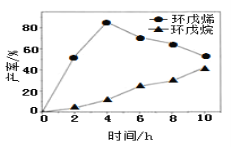
①0~4h氢化反应速率比副反应快的可能原因是_________。
②最佳的反应时间为__h。若需迅速减慢甚至停止反应,可采取的措施有____(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是 ____(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
【答案】-209.9 氢化反应的活化能小或反应物的浓度大 4 排出氢气或急剧降温 副反应增加 CD 50 3200
【解析】
(1)结合盖斯定律计算,氢化反应+副反应得到反应的△H;
(2)①根据活化能或浓度对反应速率的影响分析;
②根据图象可知,在4h时环戊烯产率最大、环戊烷产率较小;根据外界条件对化学反应速率的影响分析迅速减慢甚至停止反应的措施。
③副反应增加导致环戊烯的产率降低;
(3)①根据影响化学平衡移动的因素及物质的转化率的变化分析;
②用三段式法先计算物质的平衡物质的量,根据物质在同温同体积时压强比等于气体的物质的量之比计算平衡常数及物质产生的压强大小。
(1)结合盖斯定律计算,氢化反应+副反应得到反应![]() △H=-209.9kJ/mol;
△H=-209.9kJ/mol;
(2)①0~4h氢化反应速率比副反应快的可能原因是氢化反应的活化能小或反应物的浓度大;
②根据图象可知,在4h时环戊烯产率最大、环戊烷产率较小,说明最佳的反应时间为4h;若需迅速减慢甚至停止反应,可采取的措施有:排出氢气,或利用温度对化学反应速率的影响,将反应体系的温度降低,即急剧降温也可以降低反应速率;
③一段时间后,环戊烯产率快速下降的原因可能是副反应增加,导致环戊烯的产率降低;
(3) A.增大双环戊二烯的用量,平衡正向移动,但是加入的双环戊二烯使平衡正向移动消耗量远小于增大双环戊二烯的用量使其浓度增大的量,因此增大双环戊二烯的用量,双环戊二烯的转化率降低,A错误;
B.使用催化剂化学平衡不发生移动,双环戊二烯的平衡转化率不变,B错误;
C.及时分离产物,由于生成物浓度降低,平衡正向移动,使更多的双环戊二烯发生反应,因此双环戊二烯的转化率增大,C正确;
D.由于该反应的正反应是吸热反应,适当提高温度,化学平衡正向移动,使更多的双环戊二烯发生反应,因此双环戊二烯的转化率增大,D正确;
故答案是CD;
②假设反应前双环戊二烯的物质的量为a,水蒸气的物质的量为b,
化学反应: 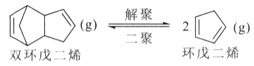
n(开始)(mol) a 0
n(转化)(mol) 0.8a 1.6a
n(平衡)(mol) 0.2a 1.6a
在同温同体积时,气体的压强与气体的物质的量呈正比,反应前总压为300 kPa,反应达到平衡后总压为500 kPa,![]() ,解得
,解得![]() ,由于反应前气体的总压强为300kPa,所以p(H2O)=
,由于反应前气体的总压强为300kPa,所以p(H2O)=![]() ×300kPa=50kPa,
×300kPa=50kPa,![]() ,由于
,由于![]() ,所以p(双环戊二烯) 平衡=50kPa,p(环戊二烯)平衡=
,所以p(双环戊二烯) 平衡=50kPa,p(环戊二烯)平衡=![]() p(双环戊二烯)平衡=8×50kPa=400kPa,所以平衡常数Kp=
p(双环戊二烯)平衡=8×50kPa=400kPa,所以平衡常数Kp=![]() =3200kPa。
=3200kPa。


科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
又知:![]()

![]() ,
,![]()

 ;
;
判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. HCl中H—Cl 键比H2O中H—O键稳定
D. 由题中所提供信息判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸钠粉末,pH增大,溶液漂白性减弱
D. 光照过程中,有气泡冒出,溶液的导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,设计成分分析方案如下,下列分析不正确的是( )
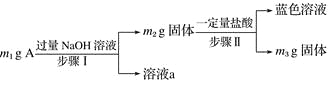
A. 当m1>m2时,溶液a中阴离子只有1种
B. 生成蓝色溶液的离子方程式涉Cu+2Fe3+===Cu2++2Fe2+
C. 要确定混合物中是否含Al,可取A加入适量稀HCl
D. 当m2-m3=2.96 g,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(![]() )的正确顺序是( )
)的正确顺序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示小麦开花数天后测定种子中主要物质的变化,请据图回答下列问题:

(1)成熟小麦种子中主要的营养物质是________。
(2)检测还原糖的试剂是________,还原糖的多少可通过________来判断。
(3)小麦种子成熟过程中,胚乳里蔗糖与还原糖含量比较,两者的变化趋势________________(填“相同”或“不同”)。
(4)种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为验证磷酸化酶是否是蛋白质,实验过程中实验组试管加入________,对照组试管中加入2 mL豆浆,然后加入等量的________,如果均出现________现象,则证明磷酸化酶是蛋白质。
(5)播种等量的小麦种子和花生种子,________种子需要浅播,因为该种子中_______化合物含量多,该化合物元素组成特点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaC1的流程如下:
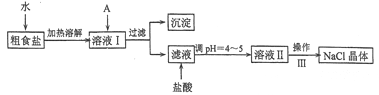
(1)加入A试剂,是为了除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子。A代表的是多种试剂,按滴加顺序依次为:iNaOH,ⅱ__________,ⅲ_________(填化学式)。
(2)请写出下列试剂加入试剂i时发生主要反应的离子反应方程式:_________
(3)右下图是某学生的过滤操作示意图,其操作不规范的是________(填标号)。
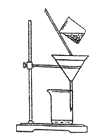
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)操作III的名称是__________
(5)mg粗盐提纯后得到ng纯净的NaCl固体,则m与n的大小关系为_________.
A.m>n B. m=n C. m<n D. 无法确定.
(6)实验室需配制480 mL0.400mol/L盐酸,现用如图所示浓盐酸配制,回答下列问题:
盐酸
分子式: HCl
相对分子质量: 36.5
密度: 1.2g/cm3
HCl的质量分数为: 36.5%
①配制需要的玻璃仪器有玻璃棒、量简、烧杯、________(填仪器名称)
②需量取浓盐酸的体积为:__________mL。(结果保留1位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com