
����Ŀ���������ʽṹ�й����ʺ��ص㣬�ش��������⣺
��1��Ti��̬ԭ�Ӻ�������Ų�ʽΪ _____��̬��ԭ�Ӻ����������״��_________�������ƣ���
��2����ϩ�棨CH2=CH-CN��������������![]() ���ĸ�����Ϊ_____,������̼ԭ�ӹ�����ӻ�������___
���ĸ�����Ϊ_____,������̼ԭ�ӹ�����ӻ�������___
��3��д����NH4+��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ______��_______��
��4���Ѵ�������ͬ���칹�壬![]() �����������ܶѻ���
�����������ܶѻ���![]() �������������ѻ������������Ѿ��������_____������
�������������ѻ������������Ѿ��������_____������![]() ת��Ϊ
ת��Ϊ![]() �������_____��������������������������
�������_____��������������������������
��5������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����____________����������
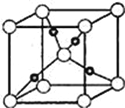
��6��Cu��OԪ���γɵ�ij�ֻ�����ľ����ṹ��ͼ��ʾ����������ԭ�ӵ���λ��Ϊ____��������٤������ΪNA�������ı߳�Ϊa pm,�þ�����ܶ�Ϊ__gcm��3��
���𰸡�1s22s22p63s23p63d24s2��[Ar] 3d24s2 ���Ρ������� 2:1 sp2 sp CH4 BH4- X-�������� ���� ������ 4 ![]()
��������
��1��Ti��22��Ԫ�أ����ݺ�������Ų����ɣ���д�����Ų�ʽ������Alԭ�Ӻ�������Ų�ʽȷ������̬��ԭ�Ӻ����������״��
��2����ϩ�����������ԭ�Ӷ���ͬһƽ����,���ϩ�������,̼ԭ�ӵ��ӻ����������sp2�ӻ���sp�ӻ�,�����������ĸ�����Ϊ2��1��
��3���ȵ�������ָ������ͬ�۵�����Ŀ��ԭ����Ŀ�ķ��ӻ����ӣ���NH4+Ϊ�ȵ�������������8���۵��ӣ�5��ԭ�ӣ�
��4��������Ķѻ���ʽ�ķ�����x-�������䣬�������ܶѻ��ռ������ʱ����������ѻ��ռ������ʸߣ���![]() ת��Ϊ
ת��Ϊ![]() ����������ͣ�
����������ͣ�
��5���õ��������������������ԭ�Ӻ�����ֵĸ����ܶȷֲ���
��6���ӽṹ���������ݾ�����ԭ�Ӹ����ļ��㷽����ȷ���������ͣ������ܶȡ�
��1��Ti��22��Ԫ�أ�����������Ų����ɣ�Tiԭ�Ӻ�������Ų�ʽΪ��1s22s22p63s23p63d24s2��[Ar] 3d24s2������Al��13��Ԫ�أ�ԭ�Ӻ�������Ų�ʽ��1s22s22p63s23p1����̬��ԭ�Ӻ����������״�У����Ρ����������֣������Ϊ��1s22s22p63s23p63d24s2��[Ar] 3d24s2 �����Ρ������Σ�
��2����ϩ�����������ԭ�Ӷ���ͬһƽ����,���ϩ�������,̼ԭ�ӵ��ӻ����������sp2�ӻ���sp�ӻ�,�����������ĸ�����Ϊ2��1�������Ϊ��2:1��sp2 sp��
��3���ȵ�������ָ������ͬ�۵�����Ŀ��ԭ����Ŀ�ķ��ӻ����ӣ���NH4+Ϊ�ȵ�������������8���۵��ӣ�5��ԭ�ӣ����NH4+��Ϊ�ȵ�����ķ����磺CH4�������磺BH4-�������Ϊ��CH4 ��BH4-��
��4��������Ķѻ���ʽ�ķ�����x-�������䣬�������ܶѻ��ռ������ʱ����������ѻ��ռ������ʸߣ���![]() ת��Ϊ
ת��Ϊ![]() ����������ͣ������Ϊ��x-�������䣻���ͣ�
����������ͣ������Ϊ��x-�������䣻���ͣ�
��5���õ��������������������ԭ�Ӻ�����ֵĸ����ܶȷֲ��������Ϊ�������ƣ�
��6��λ�ھ��������8��ԭ�ӣ�ÿ��ԭ�����ھ�����ֻ��1/8�����Ըþ����У���ԭ�Ӹ���Ϊ1+8![]() =2����ɫԭ����4�������Ը�������Cu2O���þ�������2��Cu2O���ʾ�������Ϊ144
=2����ɫԭ����4�������Ը�������Cu2O���þ�������2��Cu2O���ʾ�������Ϊ144![]() 2NA,���������Ϊ(a
2NA,���������Ϊ(a![]() )3cm3�����Ըþ������ܶ�Ϊ��
)3cm3�����Ըþ������ܶ�Ϊ��![]() g/cm3���ʱ����Ϊ��4��
g/cm3���ʱ����Ϊ��4��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����128gͭ����һ������Ũ�����в��ȡ���ͭƬ��ȫ��ʧʱ�����ռ���NO2��NO�Ļ������44.8L(��״��)��
(1)д�������������йط�Ӧ�����ӷ���ʽ��_________��____________________��
(2)��ɸ÷�Ӧ������Ҫ��ȡ10mol��L��1��Ũ����________mL��
(3)���������NO2�����Ϊ______________L��NO�����________L(��Ϊ��״����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�����ʢ��ǿ��ԭ��Һ̬����N2H4����ǿ������Һ̬˫��ˮ������0.4molҺ̬�º�0.8molH2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ������(�൱��25�桢101 kPa�²�õ�����)��
��1����Ӧ���Ȼ�ѧ����ʽΪ_____________________��
��2����֪H2O(l) = H2O(g) ��H= +44kJ/mol��
��16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������_________________kJ��
��3���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ���____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1��N2��g����H2��g����Ӧ����1molNH3��g�����ų�46.1kJ������________��
��2��1molC2H5OH��l����ȫȼ������CO2��g����H2O��g�����ų�1366.8kJ������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ɴ�����Ⱦ����Ҫ���ʣ�ij����С����������о���
��1��д��SO2��g����NO2��g����Ӧ����SO3��g����NO��g�����Ȼ�ѧ����ʽ_____________��
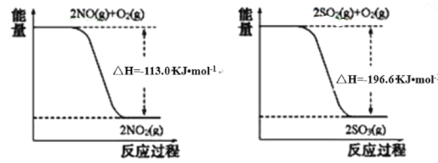
��2����������NaOH��Һ����SO2������NaOH��Һ��ͨ��������SO2ʱ���õ�NaHSO3��Һ������ͼ��ʾװ�ã��缫��Ϊ���Ե缫����pHΪ4��7֮����,��ʹNaHSO3ת��ΪNa2S2O4������ý�Ũ�����ᣬ���ǵ绯ѧ������֮һ��
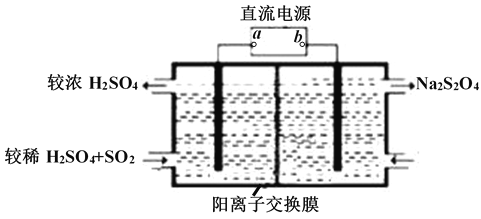
��aΪ��Դ��_______���� ������������������
�������ĵ缫��ӦʽΪ______
��.����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O����ӦΪ2Cu + H2O ==Cu2O + H2����װ����ͼ��ʾ�������ӽ���ĤΪ__________���ӽ���Ĥ(�����������)���õ�ص�������ӦʽΪ��____________________���Ѽ�������pH_______ (����С������)��
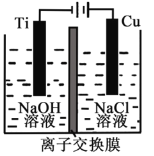
��.����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ���
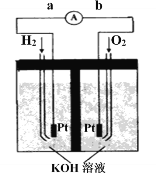
������ȼ�ϵ�ص�����ת����Ҫ��ʽ��________������ʱ��������Ϊ_______����a��b��b��a��ʾ����
�ڸ����ĵ缫��ӦʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����Һ�У����ܴ����������������( )
A.K+��Na+��SO42����Cl��B.K+��Na+��HCO3����NO3��
C.Ca2+��Na+��OH����HCO3��D.Ba2+��Na+��OH����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ʵ�����ý���ͭ��ϡ������ȡNO�����ӷ���ʽΪ______________________��
(2)NO���ж����壬ijѧ��Ϊ��ֹ��Ⱦ���÷�Һ©�����ձ�װ����һ���ġ����濪���á������ͣ��NO���巢��װ�ã���ͼ����ʾ��

��ʵ������û��ͭ˿����ֻ��Сͭ������ʹ������װ�ý���ʵ��ʱ������˿״���ϰ���ͭ���Դ���ͭ˿����ʵ�飬����˿״���ϵijɷֿ�����________(�����)��
A���� B���� C���� D������
�ڴ�Һ©���Ļ���ʹ��Ӧ���У��ڷ�Һ©����ʵ�ʿ����������Ǻ���ɫ�ģ�ԭ����__________(�ѧ����ʽ)��
(3)Ϊ֤��ͭ˿��ϡ���ᷴӦ���ɵ�ȷʵ��NO��ijѧ���������һ����ͼ����ʾ��װ����ȡNO����Ӧ��ʼ������U�ι��Ҷ˹۲쵽��ɫ��NO���塣
�ٳ������ܵ�������______________________________________________________��
���÷�Ӧֹͣ�IJ���������ԭ����__________________________________________��
(4)�����ռ�NO�����װ�ã���������________(�����)��

(5)��32.64 gͭ��140 mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ������NO��NO2��������ڱ�״���µ����Ϊ11.2 L����ش�
��NO�����Ϊ________ L��NO2�����Ϊ________ L��
�ڴ�����������ȫ���ͷź�����Һ�м���VmLamol��L��1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2��ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ________ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º����£���l molX��2 molY�����ܱ������з�����Ӧ��X(s)+2Y(g)![]() 2Z(g)��10 min��ﵽƽ��״̬������˵����ȷ����
2Z(g)��10 min��ﵽƽ��״̬������˵����ȷ����
A. ƽ��ǰ��������ѹǿ�淴Ӧ���ж���С
B. ƽ���������Y��Z�����ʵ���֮��һ��Ϊ1:1
C. 10 min�������¶ȣ�Y�ķ�Ӧ���ʲ���
D. ����Z�����ʵ���һ��С��2 moI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z�����ڱ������ڵ���Ԫ�أ�X��Yͬ���ڣ�Y��Zͬ���壬��ԭ�ӵ�����������֮��Ϊ14��������֮��Ϊ28������Ԫ��Ϊ�� ��
A.N��P��OB.N��C��SiC.C.B��Mg��AlD.C��N��P
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com