
����Ŀ���������������������ɴ�����Ⱦ����Ҫ���ʣ�ij����С����������о���
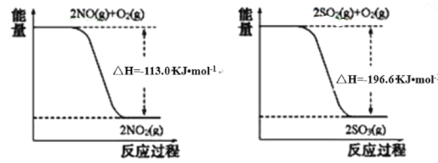
��1��д��SO2��g����NO2��g����Ӧ����SO3��g����NO��g�����Ȼ�ѧ����ʽ_____________��
��2����������NaOH��Һ����SO2������NaOH��Һ��ͨ��������SO2ʱ���õ�NaHSO3��Һ������ͼ��ʾװ�ã��缫��Ϊ���Ե缫����pHΪ4��7֮����,��ʹNaHSO3ת��ΪNa2S2O4������ý�Ũ�����ᣬ���ǵ绯ѧ������֮һ��
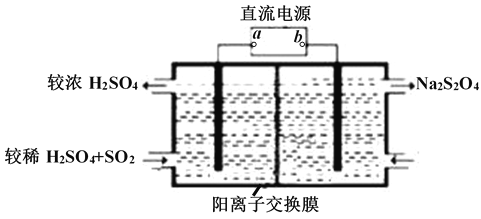
��aΪ��Դ��_______���� ������������������
�������ĵ缫��ӦʽΪ______
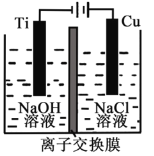
��.����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O����ӦΪ2Cu + H2O ==Cu2O + H2����װ����ͼ��ʾ�������ӽ���ĤΪ__________���ӽ���Ĥ(�����������)���õ�ص�������ӦʽΪ��____________________���Ѽ�������pH_______ (����С������)��
��.����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ���
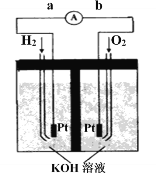
������ȼ�ϵ�ص�����ת����Ҫ��ʽ��________������ʱ��������Ϊ_______����a��b��b��a��ʾ����
�ڸ����ĵ缫��ӦʽΪ__________________��
���𰸡�SO2��g��+NO2��g��=SO3��g��+NO��g����H=-41.8kJ/mol ���� 2HSO3-+2H++2e-=S2O42-+2H2O �� 2Cu �C 2e��+ 2OH��= Cu2O + H2O ���� ��ѧ�ܡ����� b��a H2��2e��+2OH��=2H2O
��������
��1������������������ͼ������NO��O2��SO2��O2��Ӧ���Ȼ�ѧ����ʽ�����ݸ�˹����д��SO2��NO2��Ӧ���Ȼ�ѧ��Ӧ����ʽ��
��2������ͼ�е��أ�������Ӧ�ĵĻ��ϼ۱仯��������Կ���NaHSO3��Na2S2O4��S�Ļ��ϼ۽��ͣ�����b�Ǹ�������a��������
��.���ܷ�Ӧ����֪�����缫��Ӧʽ��TiΪ������H+�ŵ磬��Һ��pH����
��.ԭ����ǰѻ�ѧ��ת��Ϊ���ܵ�װ�ã�ȼ�ϵ����ԭ��أ���ԭ�����ʧ���ӵ�һ��Ϊ�������õ��ӵ�һ��Ϊ���������Ӿ������ɸ������ݵ�������������������������
��1����֪��ͼ��������2SO2��g��+O2��g���T2SO3��g������H=-196.6kJ/mol
��O2��g��+2NO��g���T2NO2��g������H=-113.0kJ/mol
���ݸ�˹����![]() �ɵã�SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol�������Ϊ��SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol��
�ɵã�SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol�������Ϊ��SO2��g��+NO2��g��=SO3��g��+NO��g������H=-41.8kJ/mol��
��2����NaHSO3��Na2S2O4��S�Ļ��ϼ۽��ͣ�����b�Ǹ�������a�������������缫��ӦʽΪ��2HSO3-+2H++2e-=S2O42-+2H2O�������Ϊ��������2HSO3-+2H++2e-=S2O42-+2H2O��
��.��Ϊ�ܷ�ӦΪ��2Cu + H2O ==Cu2O + H2��������������ӦΪ��2Cu-2e-+2OH-=Cu2O+H2O, �����ӽ���ĤӦ���������ӽ���Ĥ�������缫��ӦΪ��2H2O+2e-=H2��+2OH-, Ti��Ϊ����������������Һ��pH�������Ϊ������2Cu �C 2e- + 2OH�� = Cu2O + H2O������
��.ȼ�ϵ����ԭ��أ��ǰѻ�ѧ��ת��Ϊ���ܵ�װ�ã�������ȼ�ϵ����ͨ��H2�ĵ缫�Ǹ�����H2ʧȥ���ӣ�ͨ��O2�ĵ缫��������O2�õ����ӣ����Ӿ������ɸ������ݵ�������������b����a���������Һ�Լ��ԣ����Ը�����ӦʽΪH2-2e-+2OH-=2H2O�������Ϊ����ѧ�������ܡ�b��a��H2��2e��+2OH��=2H2O��


 �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ����
A��Cu�����Ȼ�����Һ��Cu��Fe3��=Cu2����Fe2��
B��Na2CO3��Һ�м�����CO![]() ��2H��=CO2����H2O
��2H��=CO2����H2O
C��AlCl3��Һ�м������ϡ��ˮ��Al3����4NH3��H2O=AlO![]() ��4NH
��4NH![]() ��2H2O
��2H2O
D��Ba(OH)2��Һ��ϡ��� Ba2++2OH��+2H++SO42��=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺

��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ��������� ��
��2���ձ���������ֽ���������� ��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ (����ƫ��ƫС����Ӱ����)
��4�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (������ȡ��������)�������к��� (������ȡ��������)����������
��5������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�� ��������ƫ��������ƫС��������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������Ϊx��Ԫ��E�����ڱ���λ��A��B��C��D����Ԫ���м�(��ͼ��ʾ)����A��B��C��D����Ԫ�ص�ԭ������֮�Ͳ�������(��ϵ���ϵ��0��Ԫ�س���)(����)

A. 4x B. 4x��6 C. 4x��10 D. 4x��14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʽṹ�й����ʺ��ص㣬�ش��������⣺
��1��Ti��̬ԭ�Ӻ�������Ų�ʽΪ _____��̬��ԭ�Ӻ����������״��_________�������ƣ���
��2����ϩ�棨CH2=CH-CN��������������![]() ���ĸ�����Ϊ_____,������̼ԭ�ӹ�����ӻ�������___
���ĸ�����Ϊ_____,������̼ԭ�ӹ�����ӻ�������___
��3��д����NH4+��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ______��_______��
��4���Ѵ�������ͬ���칹�壬![]() �����������ܶѻ���
�����������ܶѻ���![]() �������������ѻ������������Ѿ��������_____������
�������������ѻ������������Ѿ��������_____������![]() ת��Ϊ
ת��Ϊ![]() �������_____��������������������������
�������_____��������������������������
��5������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����____________����������
��6��Cu��OԪ���γɵ�ij�ֻ�����ľ����ṹ��ͼ��ʾ����������ԭ�ӵ���λ��Ϊ____��������٤������ΪNA�������ı߳�Ϊa pm,�þ�����ܶ�Ϊ__gcm��3��
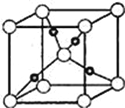
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊԭ��������������Ķ�����Ԫ��A~F�ĵ�һ��������������ݣ����еĽ���Ԫ����
������I��ev�� | A | B | C | D | E | F |
I1 | 5.2 | 7.6 | 6.0 | 11.3 | 13.6 | 14.5 |
I2 | 49.3 | 15.0 | 18.8 | 24.4 | 35.1 | 29.6 |
I3 | 71.6 | 80.1 | 28.4 | 47.9 | 54.9 | 47.4 |
I4 | 98.9 | 109.2 | 112.0 | 64.5 | 77.4 | 77.5 |
I5 | 138.3 | 141.3 | 153.7 | 392.1 | 113.9 | 97.9 |
A.A B CB.B C DC.C D ED.D E F
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaHCO3���ʵ��й�������ȷ����(����)
A. ֻ����ǿ�ᷴӦ,������ǿ�Ӧ
B. ҽ���Ͽ���������θ�����
C. ���������ᷴӦʱ�ų���CO2�ȵ�������Na2CO3Ҫ��
D. ͬ�¶�ʱ,NaHCO3���ܽ��>Na2CO3���ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ڱ���˵����ȷ���ǣ� ��
A.ͬһ����Ԫ��ԭ�ӵ�������������ͬ
B.ͬһ����Ԫ��ԭ�ӵĵ��Ӳ�����ͬ
C.�����ɼ�Ľ������ڵڢ�A��
D.����������8��Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com