
【题目】将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
(1)写出上述过程中有关反应的离子方程式:_________、____________________。
(2)完成该反应至少需要量取10mol·L-1的浓硝酸________mL。
(3)混合气体中NO2的体积为______________L,NO的体积________L(均为标准状况下)。
【答案】Cu+4H++2NO3—===Cu2++2NO2↑+2H2O 3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O 600 22.4 22.4
【解析】
(1)发生反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)反应中被还原的HNO3生成NO、NO2混合气体,未被还原的硝酸生成Cu(NO3)2,由氮原子守恒可知,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2),再根据V=![]() 计算;
计算;
(3)设混合气体中NO2、NO的物质的量分别为xmol、ymol,根据电子转移守恒及二者体积列方程计算,再根据V=nVm计算各自的体积。
(1)Cu分别溶于浓硝酸、稀硝酸发生的反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,则对应的离子反应方程式为Cu+4H++2NO3—===Cu2++2NO2↑+2H2O、3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O;
(2)反应中被还原的HNO3生成NO、NO2混合气体,混合气体的物质的量=![]() =2mol,未被还原的硝酸生成Cu(NO3)2,铜的物质的量=
=2mol,未被还原的硝酸生成Cu(NO3)2,铜的物质的量=![]() =2mol,由氮原子守恒可知,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2mol×2+2mol=6mol,故需要硝酸的体积=
=2mol,由氮原子守恒可知,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2mol×2+2mol=6mol,故需要硝酸的体积=![]() =0.6L=600mL;
=0.6L=600mL;
(3)设混合气体中NO2、NO的物质的量分别为xmol、ymol,根据电子转移守恒及二者体积,可得:x+3y=2×2、x+y=2,解得x=1、y=1;故二氧化氮的体积=1mol×22.4L/mol=22.4L,NO的体积=1mol×22.4L/mol=22.4L。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用坩埚灼烧MgCl2·6H2O的化学方程式为:MgCl2·6H2O![]() MgCl2+6H2O
MgCl2+6H2O
B. 根据表中提供的数据,等物质的量浓度的NaClO、NaHCO3 混合溶液中,有c(HCO![]() )>c(ClO-)>c(OH-)
)>c(ClO-)>c(OH-)

C. 常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一
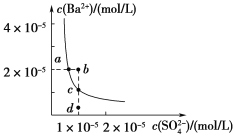
D. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO![]() ),则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点
),则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
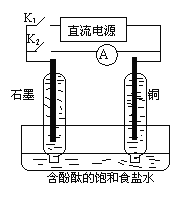
A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
①N2的电子式为________。
②上述反应离子方程式为____________,其平均反应速率v(NO)=_____mol·L-1·min-1。
③还原过程中可生成中间产物NO,写出三种促进NO水解的方法:______________。
(2)电化学降解NO的原理如图所示。
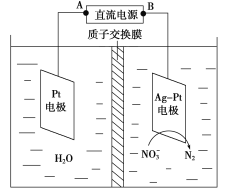
①电源正极为________(填“A”或“B”),阴极反应式为_______________。
②若电解过程中转移了2 mol电子,则质子交换膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。
请回答:
(1)A是________,Y是________,Z是________。
(2)当X是强酸时,E是________,写出B生成C的化学方程式:________________________
(3)当X是强碱时,E是________,写出B生成C的化学方程式:________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
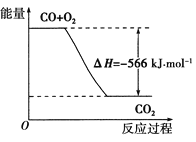
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,下列说法正确的是( )
A.CO的燃烧热为-283 kJ·mol-1
B.CO的燃烧热为566 kJ·mol-1
C.CO的燃烧热ΔH=-283 kJ·mol-1
D.如图可表示由CO生成CO2的反应过程和能量关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为 _____基态铝原子核外电子云形状有_________(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中α键和![]() 键的个数比为_____,分子中碳原子轨道的杂化类型是___
键的个数比为_____,分子中碳原子轨道的杂化类型是___
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由
采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由![]() 转变为
转变为![]() 晶体体积_____(填“膨胀”或“收缩”)。
晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。
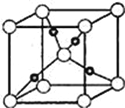
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a pm,该晶体的密度为__gcm﹣3.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com