
【题目】化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
①N2的电子式为________。
②上述反应离子方程式为____________,其平均反应速率v(NO)=_____mol·L-1·min-1。
③还原过程中可生成中间产物NO,写出三种促进NO水解的方法:______________。
(2)电化学降解NO的原理如图所示。
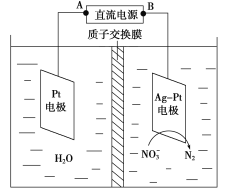
①电源正极为________(填“A”或“B”),阴极反应式为_______________。
②若电解过程中转移了2 mol电子,则质子交换膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
【答案】![]() 2NO
2NO![]() +5H2
+5H2![]() N2+2OH-+4H2O0.001加酸,升高温度,加水A 2NO
N2+2OH-+4H2O0.001加酸,升高温度,加水A 2NO![]() +6H2O+10e-===N2↑+12OH-14.4
+6H2O+10e-===N2↑+12OH-14.4
【解析】
①氮气为共价分子,氮原子间存在3个共用电子对。
②在催化剂条件下,氢气和硝酸根离子发生氧化还原反应生成氮气、水和氢氧根离子;先根据溶液pH的变化计算氢氧根离子反应速率,再根据氢氧根离子和硝酸根离子之间的关系式计算硝酸根离子反应速率。
③亚硝酸根离子水解是吸热反应,根据外界条件对其水解反应影响来分析。
(2) ①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成。
②两极的质量差实际上阳极消耗水的质量和阴极析出N2、质子交换膜进入H+的质量之差,由两极的反应方程式可得:H2O-2e-、N2-10H+-10e-,左侧减重18g,右侧减重5.6-2=3.6g,然后计算Δm左-Δm右。
(1)①N2为共价分子,氮氮间形成三键,其电子式为NN;正确答案:![]() 。
。
②反应中碱性增强,故应有OH-生成,再结合原子守恒可写出反应的离子方程式为: 5H2+2NO![]()
![]() N2+2OH-+4H2O;根据速率的计算公式v=△c/△t可知:v(NO)=v(OH-)=(10-2-10-7)/10=0.001 mol·L-1·min-1;正确答案:NO
N2+2OH-+4H2O;根据速率的计算公式v=△c/△t可知:v(NO)=v(OH-)=(10-2-10-7)/10=0.001 mol·L-1·min-1;正确答案:NO![]() +5H2
+5H2![]() N2+2OH-+4H2O;0.001。
N2+2OH-+4H2O;0.001。
③亚硝酸盐水解是吸热反应,且水解时生成氢氧根离子,稀释亚硝酸盐溶液能促进其水解,所以要使NO![]() 水解使溶液中c(OH-)变大,可促进NO
水解使溶液中c(OH-)变大,可促进NO![]() 水解的措施有加热、加水或加酸等;正确答案:加水、升高温度、加酸。
水解的措施有加热、加水或加酸等;正确答案:加水、升高温度、加酸。
(2)①NO![]() 生成N2发生了还原反应,应在电解池的阴极发生,故A为原电池的正极;阴极发生还原反应,故电极反应式为2NO
生成N2发生了还原反应,应在电解池的阴极发生,故A为原电池的正极;阴极发生还原反应,故电极反应式为2NO![]() +6H2O+10e-===N2↑+12OH-;正确答案:A;2NO
+6H2O+10e-===N2↑+12OH-;正确答案:A;2NO![]() +6H2O+10e-===N2↑+12OH-。
+6H2O+10e-===N2↑+12OH-。
②由电极反应式可知,转移2mol电子,溶液减少的质量[m(N2)]为5.6 g,同时有2molH+通过质子交换膜进入右侧,故右侧溶液减少3.6g。阳极发生的反应为4OH--4e-===O2↑+2H2O,每转移2mol电子,生成16gO2,同时有2mol H+通过质子交换膜进入右侧,使左侧溶液质量减少18g,故两侧溶液减少的质量差为14.4 g;正确答案:14.4。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
溶液的pH | 加入盐酸的总体积 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是 ( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述中,说法正确的是
A.Na在空气中燃烧,发出黄色火焰B.Na在空气中燃烧,产物是Na2O
C.Na是银白色金属,硬度大,熔点高D.Na可以在空气中稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况)。
(1)写出上述过程中有关反应的离子方程式:_________、____________________。
(2)完成该反应至少需要量取10mol·L-1的浓硝酸________mL。
(3)混合气体中NO2的体积为______________L,NO的体积________L(均为标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
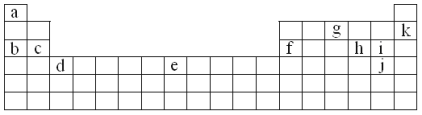
在上表中用字母代号回答下列问题:
(1)属于碱金属元素的有______________________;
(2)写出下列元素在周期表中的位置:c_______________;e_______________;
(3)X、Y、Z、T、V为5种短周期元素,X、Y、Z在周期表中位置如图所示。这3种元素原子序数之和是41,X和T在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。V单质在Z单质中燃烧产生苍白色火焰,产物溶于水能使紫色石蕊溶液变红,则:
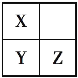
①5种元素的元素符号分别是X___________,Y________,Z________,T_______, V____。
②Y的原子结构示意图是____________________________________。
③T、X形成化合物T2X2的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
A. X为0.2 mol·L-1
B. Y为0.1 mol·L-1
C. Z为0.3 mol·L-1
D. Z为0.1 mol·L-1时,Y为0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

(1)步骤I中涉及的主要反应用离子方程式表示为__________.
(2)步骤Ⅱ中试剂①是_______(填代号).
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______(计算结果精确到0.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,不能大量共存的离子组是( )
A.K+、Na+、SO42-、Cl-B.K+、Na+、HCO3-、NO3-
C.Ca2+、Na+、OH-、HCO3-D.Ba2+、Na+、OH-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com