
����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����ijһ��ѧԪ�ء�
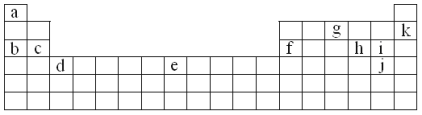
���ϱ�������ĸ���Żش��������⣺
��1�����ڼ����Ԫ�ص���______________________��
��2��д������Ԫ�������ڱ��е�λ�ã�c_______________��e_______________��
��3��X��Y��Z��T��VΪ5�ֶ�����Ԫ��,X��Y��Z�����ڱ���λ����ͼ��ʾ����3��Ԫ��ԭ������֮����41,X��T�ڲ�ͬ�����·�Ӧ,��������T2X(��ɫ����)��T2X2(����ɫ����)���ֻ����V������Z������ȼ�ղ�����ɫ����,��������ˮ��ʹ��ɫʯ����Һ���,��:
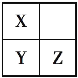
��5��Ԫ�ص�Ԫ�ط��ŷֱ���X___________,Y________,Z________,T_______, V____��
��Y��ԭ�ӽṹʾ��ͼ��____________________________________��
��T��X�γɻ�����T2X2�Ļ�ѧ����ʽΪ______________________________��
���𰸡�b �������ڵڢ�A�� �������ڵ�VIII�� O S Cl Na H ![]() 2Na+O2
2Na+O2![]() Na2O2
Na2O2
��������
��Ԫ�������ڱ���λ�ÿ�֪��aΪH��bΪNa��cΪMg��fΪAl��gΪN��kΪNe��hΪS��iΪCl��jΪBr��dΪSc��eΪFe��
(1)λ�ڵ�1�е�Ϊ�����Ԫ�أ�H���⣻
(2)���Ԫ�����ڱ��Ľṹȷ��c��eԪ�������ڱ��е�λ�ã�
(3)X��Y��Z��T��VΪ5�ֶ�����Ԫ�أ�X��Y��Z����Ԫ��ԭ������֮����41������Ԫ�������ڱ���λ�ÿ�֪�������ǵ�һ��������Ԫ�أ��ֱ�Ϊ����������Ԫ�أ���X��ԭ������Ϊa����Y��Z��ԭ�������ֱ�Ϊa+8��a+9����a+a+8+a+9=41�����a=8����XΪ����YΪ��ZΪCl��X��T�ĵ����ڲ�ͬ�����·�Ӧ���������ɻ�����T2X(��ɫ����)��T2X2(����ɫ����)���ֻ������TΪNa��V������Z������ȼ�ղ�����ɫ���棬��������ˮ��ʹʯ����Һ��죬��VΪ�⣬�ݴ˽��
��Ԫ�������ڱ���λ�ÿ�֪��aΪH��bΪNa��cΪMg��fΪAl��gΪN��kΪNe��hΪS��iΪCl��jΪBr��dΪSc��eΪFe��
(1)���ڼ����Ԫ�ص���Na������Ϊb��
(2)cΪMgԪ�أ���Ԫ�����ڱ��е�λ��Ϊ�������ڵڢ�A�壻eΪFeԪ�أ���Ԫ�����ڱ��е�λ��Ϊ�������ڵ�VIII�壻
(3)X��Y��Z��T��VΪ5�ֶ�����Ԫ�أ�X��Y��Z����Ԫ��ԭ������֮����41������Ԫ�������ڱ���λ�ÿ�֪�������ǵ�һ��������Ԫ�أ��ֱ�Ϊ����������Ԫ�أ���X��ԭ������Ϊa����Y��Z��ԭ�������ֱ�Ϊa+8��a+9����a+a+8+a+9=41�����a=8����XΪ����YΪ��ZΪCl��X��T�ĵ����ڲ�ͬ�����·�Ӧ���������ɻ�����T2X(��ɫ����)��T2X2(����ɫ����)���ֻ������TΪNa��V������Z������ȼ�ղ�����ɫ���棬��������ˮ��ʹʯ����Һ��죬��VΪ�⣻
��������������֪��X��Y��Z��T��V��Ԫ�ط��ŷֱ�ΪO��S��Cl��Na��H��
��YΪSԪ�أ�ԭ��������Ϊ16��ԭ�ӵĽṹʾ��ͼΪ ��
��
��T��X�γɻ�����T2X2�Ļ�ѧ����ʽΪ��2Na+O2![]() Na2O2��
Na2O2��


 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӱ���Ϊ����ӡ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJmol��1��ʾ��������۲���ͼ��Ȼ��ش����⣮
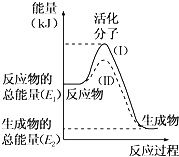
��1��ͼ����ʾ��Ӧ��______��������������������������Ӧ��
��2����֪��1mol H��H����1mol I��I��1mol H��I���ֱ���Ҫ���յ�����Ϊ436kJ��151kJ��299kJ������1mol������1mol�ⷴӦ����HI��______�������ų���������������______ kJ���������ڻ�ѧ��Ӧ�����У��ǽ�______ ת��Ϊ______��
��3�����з�Ӧ�У����ڷ��ȷ�Ӧ����______���������ȷ�Ӧ����______��
������ȼ�� ��ըҩ��ը ������кͷ�Ӧ ��������̼ͨ�����ȵ�̼��Ba��OH��28H2O��NH4Cl��Ӧ ��������ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ���������У���ȷ����( )
A.ֻ�ɷǽ���Ԫ����ɵĻ������У�һ���ǹ��ۻ�����
B.ij�����У����ڽ���Ԫ�أ��������һ�������ӻ�����
C.�������Ӽ��Ļ���������ӻ�����
D.���й��ۼ��Ļ�����ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����϶������Dzⶨ�������е������ľ��䷽������ԭ������Ũ�����ڴ��������½���Ʒ���л���ת������Σ�������ͼ��ʾװ�ô�����Σ�Ȼ��ͨ���ζ���������֪��
NH3+H3BO3=NH3��H3BO3��
NH3��H3BO3+HCl= NH4Cl+ H3BO3��

�ش��������⣺
��1��a��������_______________��
��2��b�з����������Ƭ��Ŀ����____________��f��������__________________��
��3����ϴ������g�м�����ˮ����k1���ر�k2��k3������b������������·��ֹͣ���ȣ��ر�k1��g������ˮ��������c��ԭ����____________����k2�ŵ�ˮ���ظ�����2~3�Ρ�
��4��������ϴ��g�м������ᣨH3BO3����ָʾ�������������dע��e�����ע������������Һ��������ˮ��ϴd���ر�k3��d�б�������ˮ����k1������b��ʹˮ��������e��
��d�б�������ˮ��Ŀ����___________________��
��e����Ҫ��Ӧ�����ӷ���ʽΪ________________��e�����п�˫�㲣��ƿ��������________��
��5��ȡij�ʰ��ᣨC2H5NO2����Ʒm �˽��вⶨ���ζ�g������Һʱ����Ũ��Ϊcmol��L-1������V mL������Ʒ�е�����������Ϊ_________%����Ʒ�Ĵ��ȡ�_______%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ڻ�������������ʮ����Ҫ�����á������������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
(1)�����������У�H2�ܽ�NO��ԭΪN2��25 ��ʱ����Ӧ����10 min����Һ��pH��7��Ϊ12��
��N2�ĵ���ʽΪ________��
��������Ӧ���ӷ���ʽΪ____________����ƽ����Ӧ����v(NO)��_____mol��L��1��min��1��
�ۻ�ԭ�����п������м����NO��д�����ִٽ�NOˮ��ķ�����______________��
(2)�绯ѧ����NO��ԭ����ͼ��ʾ��
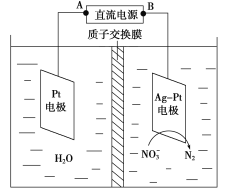
�ٵ�Դ����Ϊ________(�A����B��)��������ӦʽΪ_______________��
������������ת����2 mol���ӣ������ӽ���Ĥ������Һ�������仯��(��m������m��)Ϊ________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��Mg2����Al3����NH4��������Һ�еμ�NaOH��Һʱ������������NaOH������Ĺ�ϵͼ��
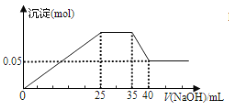
�� ��
���и�������ʾ��ͼһ�µ��ǣ� ��
A. ͼ���������ӵ����ʵ���֮��Ϊ:n(Mg2��):n(Al3��):n(NH4��)��2:3:2
B. ͼ�������߱�ʾij��Ӧ���̵������仯�� ��ʹ�ô�����B��ή��
C. ͼ����ʹ�õ�NaOH��Ũ��Ϊ2 mol/L
D. ͼ��������A��Ӧ��������C����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Ũ�ȶ���0.1mol��L-1��X2��Y2��������������ܱ������У�ʹ֮������Ӧ��������Z���ﵽƽ��ʱc(X2)=0.04mol��L-1��c(Y2)=0.08mol��L-1��c(Z)=0.04mol��L-1����÷�Ӧ�ķ�Ӧʽ��
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ΪԪ�����ڱ���һ���֣������A��K��ʮ��Ԫ������λ�á�����Ԫ�ط��Ż�ѧʽ�ش��������⣮
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | A | B | ||||||
3 | C | D | E | F | G | |||
4 | H | I | K |
��1��10��Ԫ���У���ѧ��������õ���______������õĽ�����_____��
��2��C��E��F����Ԫ���γɵļ����Ӱ뾶��С����_______��
��3��C��K�γɵĻ������л�ѧ������������________
��4��������C2B2�ĵ���ʽΪ__________________���û������AB2��Ӧ�Ļ�ѧ����ʽΪ__________________________________________��
��5��E���������������________________���������������������Һ��Ӧ�����ӷ���ʽΪ____________________________________________��
��6��D�ĵ�����A��B�γɻ�������ȼ�յĻ�ѧ����ʽΪ________________________��
��7���õ���ʽ��ʾH��B��ɵ�H2B�ͻ�������γɹ��̣�_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com