
����Ŀ��VIA�����������(Se)����(Te)��Ԫ���ڻ������г����ֳ���������̬����VIA��Ԫ�صĻ��������о�����������������Ҫ��;����ش��������⣺
(1)S���ʵij�����ʽΪS8���价״�ṹ����ͼ��ʾ��Sԭ�Ӳ��õĹ���ӻ���ʽ��___________��
![]()
(2)ԭ�ӵĵ�һ��������ָ��̬�����Ի�̬ԭ��ʧȥһ������ת��Ϊ��̬��̬����������Ҫ�����������O��S��Seԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ________________��
(3)Seԭ������Ϊ___________�������M����ӵ��Ų�ʽΪ___________��
(4)H2Se�����Ա�H2S_____________(����ǿ����������)����̬SeO3���ӵ����幹��Ϊ___________��
(5)����������Ƭ������ȱ����ƶѪ��Ԥ�������Ƶij���ҩ��ٴ��������ά����C�ٽ��������������գ���������Fe3+���ӽṹ�Ƕ�������Fe2+ �ױ�������Fe3+��ԭ����______________��
���𰸡�sp3 O>S>Se 34 3s23p63d10 ǿ ƽ�������� Fe2+�۵���3d6��ʧȥһ�����Ӵ��ȶ�״̬
��������
��1����S8���ӽṹ��֪����S8������Sԭ�ӳɼ����Ӷ���Ϊ2���µ��Ӷ���Ϊ2�����۲���Ӷ���Ϊ4�����Sԭ�Ӳ��õ��ӻ���ʽΪsp3��
��2��ͬ����Ԫ�ش��ϵ���Ԫ�صĵ�һ��������С������O��S��Se��
��3��Seλ��Ԫ�����ڱ��������ڵڢ�A�壬ԭ������Ϊ34�����������Ų�ʽΪ1s22s22p63s23p63d104s24p4�������M����ӵ��Ų�ʽΪ3s23p63d10��
��4��ͬ����Ԫ�ض�Ӧ���⻯���У�Ԫ�صķǽ�����Խǿ����Ӧ���⻯�������Խ������H2Se�����Ա�H2Sǿ����̬SeO3������Se�γ�3��������û�йµ��Ӷԣ�Ϊƽ�������η��ӣ�
��5���ӽṹ�Ƕ�������Fe2+ �ļ۵����Ų�ʽ�ǣ�3d6����ʧһ�����Ӿ���3d5������ȶ��ṹ����Fe2+�۵���3d6��ʧȥһ�����Ӵ��ȶ�״̬��


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӹ���ķ�����Һ�к���2%��5%��NaNO2������һ�ֻ�����Ⱦ�������NH4Cl��Һ�������˷�����Һ��ʹ��������ת��Ϊ�����ʡ��÷�Ӧ���������У�
��һ����NaNO2+NH4Cl=NaCl+NH4NO2
�ڶ�����NH4NO2![]() N2��+2H2O
N2��+2H2O
���жԵڶ�����Ӧ����������ȷ����
��NH4NO2����������
��NH4NO2���ǻ�ԭ��
��NH4NO2�����˷ֽⷴӦ
��ֻ�е�Ԫ�صĻ��ϼ۷����˱仯
��NH4NO2�������������ǻ�ԭ��
A. �٢� B. �٢�
C. �ڢۢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�̬��������������У����¹����H2O��CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��

A. X�ǵ�Դ�ĸ���
B. �����ķ�Ӧʽ�ǣ�H2O��2e����H2��O2��CO2��2e����CO��O2��
C. �ܷ�Ӧ�ɱ�ʾΪ��H2O��CO2H2��CO��O2
D. �������������ɵ���������ʵ���֮����1�U1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298 Kʱ����20 mL 0.1 mol��L1ROH��Һ�еμ�0.1 mol��L1���ᣬ�����Һ��pH����������Ĺ�ϵ��ͼ��ʾ����֪298 KʱROH�ĵ����Ϊ1.37%��lg 1.37��0.1������˵����ȷ����
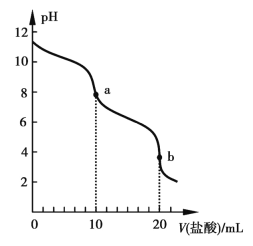
A. ˮ�ĵ���̶ȣ�a>b
B. pH=7ʱ����Һ��c(R+)=c(Cl)=c(H+)=c(OH)
C. b����Һ�д���c(C![]() )>c(R+)>c(OH)>c(H+)
)>c(R+)>c(OH)>c(H+)
D. 298 Kʱ0.1 mol��L1ROH��Һ��pH��11.1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д��CH3CH=CHCH3����ϩ����˳�����칹��Ľṹ��ʽ��________��__________��
��2������������������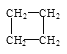 ��
��![]() ��������������
��������������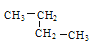 ��
��![]() �����Т� �� �� ���������ʰ����ǵķе��ɸߵ��͵�˳��������ȷ����______________������ţ����������Ģ٢ۢ��������ʣ���ȫȼ��ʱ����O2�����ʵ����ɶൽ�ٵ�˳��Ϊ_________��
�����Т� �� �� ���������ʰ����ǵķе��ɸߵ��͵�˳��������ȷ����______________������ţ����������Ģ٢ۢ��������ʣ���ȫȼ��ʱ����O2�����ʵ����ɶൽ�ٵ�˳��Ϊ_________��
��3��ij�������ķ���ʽΪC8H10���������е�ͬ���칹�干 _______�֣�����________���ṹ��ʽ���ڱ����ϵ�һ�����ֻ�����֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�124 g P4������P��P����ĿΪ4NA
B. 100 mL 1mol��L1FeCl3��Һ������Fe3+����ĿΪ0.1NA
C. ��״���£�11.2 L�������ϩ������к���ԭ����ĿΪ2NA
D. �ܱ������У�2 mol SO2��1 mol O2����Ӧ���������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4HCl(g)��O2(g) ![]() 2Cl2(g)��2H2O(g)�У�4 mol HCl ���������ų�115.6 kJ��������
2Cl2(g)��2H2O(g)�У�4 mol HCl ���������ų�115.6 kJ��������
��֪��![]()

![]() ��
��![]()

 ��
��
�ж�����˵����ȷ���ǣ�������
A. �÷�Ӧ����H����115.6 kJ��mol��1
B. �Ͽ�1 mol H��O ����Ͽ�1 mol H��Cl �������������ԼΪ32 kJ
C. HCl��H��Cl ����H2O��H��O���ȶ�
D. ���������ṩ��Ϣ�ж���Ԫ�صķǽ����Ա���Ԫ��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�����������������ȷ����
A������NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2L
B��40gNaOH�ܽ���1Lˮ�У����Ƶõ���Һ�����ʵ���Ũ��Ϊ1molL��1
C����״���£�11.2L���Ȼ�̼����������Ϊ0.5NA
D�����³�ѹ�£�5.6g������������ᷴӦת�Ƶ�������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��Al2O3��Fe3O4��Al��Cu�е�ij���ַ�ĩ��϶��ɣ���Ƴɷַ����������£����з�������ȷ���ǣ� ��
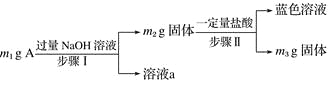
A. ��m1>m2ʱ����Һa��������ֻ��1��
B. ������ɫ��Һ�����ӷ���ʽ��Cu��2Fe3��===Cu2����2Fe2��
C. Ҫȷ����������Ƿ�Al����ȡA��������ϡHCl
D. ��m2��m3��2.96 g��Fe3O4����������Ϊ2.32 g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com