
【题目】如图为原电池装置示意图。
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
【答案】B Al-3e-+4OH-===![]() +2H2O PbO2+
+2H2O PbO2+![]() +4H++2e-===PbSO4+2H2O 增加 0.1NA H2+2OH--2e-===2H2O 减弱
+4H++2e-===PbSO4+2H2O 增加 0.1NA H2+2OH--2e-===2H2O 减弱
【解析】
(1)铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,根据负极金属单质上电子来判断;碱性条件下,Al失电子生成偏铝酸根离子;
(2)B为PbO2,是原电池的正极,发生还原反应,注意电解质溶液是硫酸;A是Pb,其离子能够与硫酸根反应生成沉淀;据电池反应式计算;
(3)氢氧燃料电池中,氢气在负极发生氧化反应,碱性环境中生成水,氢氧燃料电池反应生成水,导致电解质溶液浓度降低。
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,铝钝化,所以Cu失电子作负极,一组插入烧碱溶液中,Cu与氢氧化钠不反应,Al失电子作负极,碱性条件下,Al失电子生成偏铝酸根离子,其电极反应为:Al+4OH--3e-=AlO2-+2H2O;
(2)B为PbO2,是原电池的正极,发生还原反应,电解质溶液是硫酸,铅离子能够与硫酸根离子生成沉淀,电极反应式为:PbO2+SO42-+4H++2e-=PbSO4+2H2O;A极Pb失电子生成铅离子能够与硫酸根反应生成沉淀,导致质量增大;据电池反应式可知,每有2mol硫酸反应转移电子2mol,则0.1mol硫酸反应转移电子数目为0.1NA;
(3)氢氧燃料电池中,氢气在负极发生氧化反应,碱性环境中生成水,A为负极,负极的电极反应式为:H2+2OH--2e-=2H2O,因为生成水,导致电解质溶液的浓度减小,所以KOH溶液的碱性减弱。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
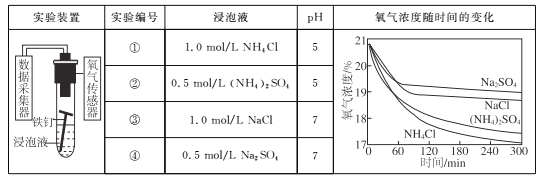
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
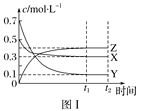
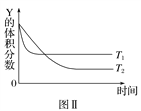
A. 该反应的热化学方程式为X(g)+3Y(g) ![]() 2Z(g) ΔH>0
2Z(g) ΔH>0
B. 若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C. 温度分别为T1和T2时的平衡常数大小关系为K2>K1
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
A. 原子半径X>Y B. 氢化物稳定性H2X>HY
C. 原子核内质子数R<M D. 溶液碱性R(OH)2<M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
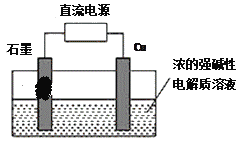
【题目】I、依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设
计的原电池如图所示。请回答下列问题:

(1)电极X的材料是___________;(填化学式)电解质溶液Y是___________;X电极上发生的电极反应为________________________________;
(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,请写出负极的电极反应式____________________________在电池工作时,正极附近溶液的PH_________,(填,增大、减小或不变)
II、用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。铜电极为_________(填“阳极”和“阴极”)写出铜电极的电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离常数约为1×10-7
D. 稀释HA溶液时,不是所有粒子浓度都一定会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置用乙醇和浓硫酸反应制取乙烯,再用乙烯与溴的四氯化碳溶液反应制备1,2-二溴乙烷。

(1)在装置A中,生成的气体除乙烯外还有乙醚、CO2、SO2等,则生成乙烯的化学方程式为_______________,河沙的作用是________________。仪器a的名称为____________。
(2)装置B可起到安全瓶的作用,若气压过大,该装置中出现的现象为________。
(3)装置C可除去CO2、SO2,所盛放的溶液为________________________。
(4)装置D中进行的主要反应的化学方程式为____________;把试管置于盛有冰水的小烧杯中的目的是___________________________。
(5)装置E的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含 Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下图所示。下列说 法中正确的是
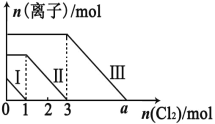
A. 线段Ⅲ代表 Fe2+的变化情况
B. 线段Ⅰ代表 Br -的变化情况
C. 原混合溶液中 n(FeBr2)=4mol
D. a 数值等于 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com