
【题目】I、依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设
计的原电池如图所示。请回答下列问题:

(1)电极X的材料是___________;(填化学式)电解质溶液Y是___________;X电极上发生的电极反应为________________________________;
(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,请写出负极的电极反应式____________________________在电池工作时,正极附近溶液的PH_________,(填,增大、减小或不变)
II、用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。铜电极为_________(填“阳极”和“阴极”)写出铜电极的电极反应式_______________________。
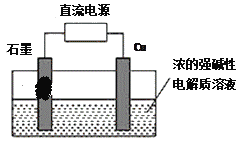
【答案】CuAgNO3Cu-2e- =Cu2+CH4 - 8e- + 10OH- = CO32- + 7H2O增大阳极2Cu +2OH-- 2e- =Cu2O + H2O
【解析】
I、(1)氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)中,失电子的金属Cu为负极,得电子的阳离子Ag+是电解质中的阳离子,所以电解质可以选择AgNO3溶液;在原电池反应2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)中,失电子的金属Cu为负极,发生失电子的氧化反应,即Cu-2e- =Cu2+;(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,通入甲烷的一极为原电池的负极,电极反应式为CH4 - 8e- + 10OH- = CO32- + 7H2O;在电池工作时,通入氧气的一极发生电极反应为O2+2H2O+4e-=4OH-;附近溶液的pH增大;II、结合装置图及总电极反应式可以得知,Cu在阳极放电,生成的亚铜离子与氢氧根离子反应生成Cu2O和水,故铜电极的电极反应式为2Cu +2OH-- 2e- =Cu2O + H2O。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 核素![]() H的中子数是0 B. 12C和14C互为同位素
H的中子数是0 B. 12C和14C互为同位素
C. 金刚石、石墨和富勒烯互为同素异形体 D. CH3CH2OH和CH3OCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要化工原料,难溶于水,在潮湿空气中易水解氧化。回答下列问题:
(1)CuCl的保存方法是_______。
(2)CuCl在含一定浓度Cl-溶液中会部分溶解,存在如下平衡:2CuCl(s)![]() Cu++CuCl2- ΔH<0。溶液中c(Cu+)和c(CuCl2-)的关系如图。
Cu++CuCl2- ΔH<0。溶液中c(Cu+)和c(CuCl2-)的关系如图。
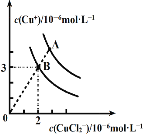
①上述反应在B点的平衡常数K=_____。
②使图中的A点变为B点的措施可以是_____。
(3)利用CuCl难溶于水的性质,可以除去水溶液中的Cl-。
①除Cl-的方法是向含Cl-的溶液同时加入Cu和CuSO4。反应的离子方程式为________。
②已知:Cu+Cu2+![]() 2Cu+ K1=7.6×10-7;Ksp(CuCl)=2.0×10-6。通过计算说明上述除Cl-的反应能完全进行的原因。_____
2Cu+ K1=7.6×10-7;Ksp(CuCl)=2.0×10-6。通过计算说明上述除Cl-的反应能完全进行的原因。_____
③若用Zn替换Cu可加快除Cl-速率,但需控制溶液的pH。若pH过低,除Cl-效果下降的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法,如图所示两个装置都可以制取蒸馏水。
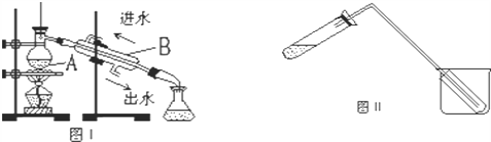
(1)图Ⅰ是实验室制取蒸馏水的常用装置,仪器A、B的名称分别是:
A_________、B___________
(2)温度计水银球应置于_________________________
(3)实验时A 中除加入一定量的自来水外,还需加入少量________,其作用是___________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长。其作用是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
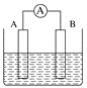
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
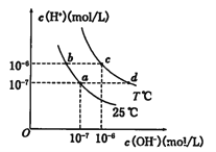
A. 向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
B. 25℃时,加入CH3COONa可能引起由c向d的变化,升温可能引起a向c的变化
C. T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是
A. 氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C. 铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D. 碳酸钙溶于稀盐酸中:CaCO3+2H+="==" Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外, 曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_____。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液。
① [Ni(NH3)6]SO4中 H、N、O 元素的电负性由大到小的顺序为_____;SO42-的立体构型是_________;与 SO42-互为等电子体的微粒为_____(填化学式,任写一种)。
② 氨的沸点高于膦(PH3),原因是______; 氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 。
(3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol ,INi=1753kJ/mol ,第二电离 ICu>INi 的原因是____________。
(4)铜的某种氯化物不仅易溶于水,而且易溶于乙醇和丙酮,其链状结构如图所示,则该氯化物的 化学式为____________________,属于_____晶体。

(5)Cu2+与乙二胺可形成上右图所示配离子,其中所含化学键类型有 ____(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键 e.金属键
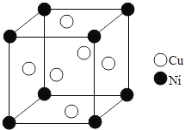
(6)某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com