
【题目】蒸馏是实验室制备蒸馏水的常用方法,如图所示两个装置都可以制取蒸馏水。
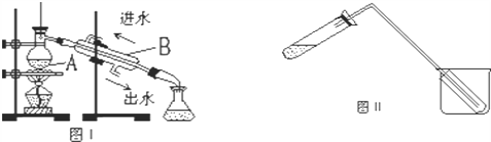
(1)图Ⅰ是实验室制取蒸馏水的常用装置,仪器A、B的名称分别是:
A_________、B___________
(2)温度计水银球应置于_________________________
(3)实验时A 中除加入一定量的自来水外,还需加入少量________,其作用是___________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长。其作用是________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1 mol,完全燃烧得0.15 mol CO2和3.6 g H2O,下列关于该混合气体的说法正确的是
A. 一定有乙烯B. 一定没有乙烯
C. 可能有甲烷D. 一定没有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
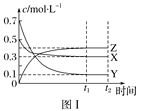
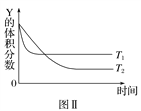
A. 该反应的热化学方程式为X(g)+3Y(g) ![]() 2Z(g) ΔH>0
2Z(g) ΔH>0
B. 若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C. 温度分别为T1和T2时的平衡常数大小关系为K2>K1
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
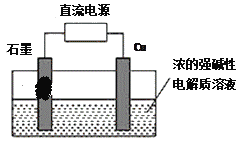
【题目】I、依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设
计的原电池如图所示。请回答下列问题:

(1)电极X的材料是___________;(填化学式)电解质溶液Y是___________;X电极上发生的电极反应为________________________________;
(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,请写出负极的电极反应式____________________________在电池工作时,正极附近溶液的PH_________,(填,增大、减小或不变)
II、用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。铜电极为_________(填“阳极”和“阴极”)写出铜电极的电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体。Q和X形成的离子化合物XQ是碱石灰的主要成分。X、Y、Z位于同一周期,Y的外围电子数是最外层电子数的6倍,Z位于ds区且不能和稀硫酸反应生成H2。请回答下列问题:
(1)Q的价层电子排布式为___________________,L的含氧酸HLO3中L的杂化方式为__________,酸根LO3-的离子构型为________________。
(2)ZR42-的配体是______,在ZSO4溶液中加入过量KCN,生成配合物[Z(CN)4]2—,则1mol该配合物中含有的π键的数目是_______。与Z同周期的元素中,与Z原子最外层电子数相等的元素还有_________(填元素符号)
(3)Y的氧化物呈如下图所示的无限链状结构,则该氧化物的化学式为______________。

(4)X和Z的晶体堆积模型相同,配位数为______________,已知X原子半径约为200pm,则晶体X的密度为__________________g/cm3(计算结果保留两位有效数字)。
(5)XL2晶体含有层状结构,其层内有强极性共价键,层间以范德华力相连接,则XL2的晶体类型是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com