
【题目】能正确表示下列化学反应的离子方程式的是
A. 氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C. 铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D. 碳酸钙溶于稀盐酸中:CaCO3+2H+="==" Ca2++H2O+CO2↑
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
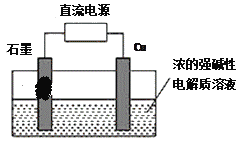
【题目】I、依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设
计的原电池如图所示。请回答下列问题:

(1)电极X的材料是___________;(填化学式)电解质溶液Y是___________;X电极上发生的电极反应为________________________________;
(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,请写出负极的电极反应式____________________________在电池工作时,正极附近溶液的PH_________,(填,增大、减小或不变)
II、用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。铜电极为_________(填“阳极”和“阴极”)写出铜电极的电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体。Q和X形成的离子化合物XQ是碱石灰的主要成分。X、Y、Z位于同一周期,Y的外围电子数是最外层电子数的6倍,Z位于ds区且不能和稀硫酸反应生成H2。请回答下列问题:
(1)Q的价层电子排布式为___________________,L的含氧酸HLO3中L的杂化方式为__________,酸根LO3-的离子构型为________________。
(2)ZR42-的配体是______,在ZSO4溶液中加入过量KCN,生成配合物[Z(CN)4]2—,则1mol该配合物中含有的π键的数目是_______。与Z同周期的元素中,与Z原子最外层电子数相等的元素还有_________(填元素符号)
(3)Y的氧化物呈如下图所示的无限链状结构,则该氧化物的化学式为______________。

(4)X和Z的晶体堆积模型相同,配位数为______________,已知X原子半径约为200pm,则晶体X的密度为__________________g/cm3(计算结果保留两位有效数字)。
(5)XL2晶体含有层状结构,其层内有强极性共价键,层间以范德华力相连接,则XL2的晶体类型是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置用乙醇和浓硫酸反应制取乙烯,再用乙烯与溴的四氯化碳溶液反应制备1,2-二溴乙烷。

(1)在装置A中,生成的气体除乙烯外还有乙醚、CO2、SO2等,则生成乙烯的化学方程式为_______________,河沙的作用是________________。仪器a的名称为____________。
(2)装置B可起到安全瓶的作用,若气压过大,该装置中出现的现象为________。
(3)装置C可除去CO2、SO2,所盛放的溶液为________________________。
(4)装置D中进行的主要反应的化学方程式为____________;把试管置于盛有冰水的小烧杯中的目的是___________________________。
(5)装置E的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、环境密切相关。如图为雾霾的主要成分示意图。下列说法不正确的是

A. 雾属于胶体,能产生丁达尔效应
B. SO2 和 N xOy 都属于酸性氧化物
C. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
D. 重金属离子可导致蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系:
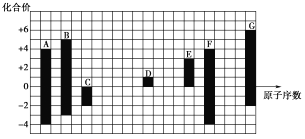
(1)元素A位于周期表中第______周期______族;
(2)元素G的最高价氧化物对应水化物的浓溶液与灼热的A的单质反应_________。
(3)D、G的形成化合物所含化学键类型为______。
(4)C2-、D+、G2-半径由大到小的顺序是________(填离子符号)。
(5)F、C所形成的化合物是___________晶体。
(6)C与D形成的具有强氧化性的化合物的电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
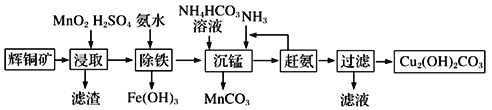
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com