
【题目】向仅含 Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下图所示。下列说 法中正确的是
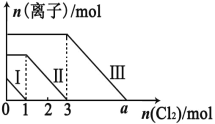
A. 线段Ⅲ代表 Fe2+的变化情况
B. 线段Ⅰ代表 Br -的变化情况
C. 原混合溶液中 n(FeBr2)=4mol
D. a 数值等于 6
【答案】C
【解析】
试题向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况.由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol.A、由上述分析可知,线段Ⅲ代表Br-的变化情况,A项错误;B、由上述分析可知,线段I代表I-的变化情况,B项错误;C、由上述分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,C项正确;D、溶液中n(Br-)=6mol,所以原混合溶液中n(FeBr2)=3mol,c(FeBr2)=3mol·L-1,D项错误;答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
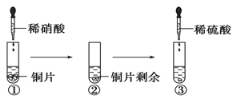
①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、Al2(SO4)3的混合済液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如右图所示,则原溶液中SO42—与Cl—的物质的量之比是( )
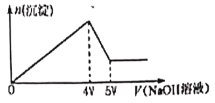
A. 1:2 B. 1:1 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关碱金属的叙述正确的是( )
A.随核电荷数的增加,密度逐渐增大
B.碱金属单质的金属性很强,均易与Cl2、O2、N2等发生反应
C.Cs2CO3加热时不能分解为CO2和Cs2O
D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓硝酸中放入铜片:
(1)反应开始的化学方程式为_________________________________________;
(2)根据上述实验现象,表明硝酸具有_____________填序号;
①酸性 ②不稳定性 ③强氧化性
(3)用V L的试管装满NO2气体,并倒扣在足量的水中,待试管中液面不再上升时,试管中溶液的浓度为_____________;(气体摩尔体积用Vm表示)
(4)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________________________________离子方程式;
(5)若将12.8g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6L标准状况,则所消耗的硝酸的物质的量是_____________,反应中转移的电子的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应,2R—C≡C—H![]() R—C≡C—C≡C—R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R—C≡C—C≡C—R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
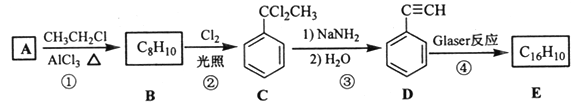
回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
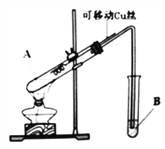
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______.
(2)W与Y可形成化合物W2Y,该化合物的电子式为______.
(3)Y在周期表中的位置是______.
(4)比较W、X、Y、Z四种元素简单离子的半径大小(用化学式表示,下同):______;比较Y、Z的气态氢化物稳定性强弱:______>______.
(5)X的硝酸盐水溶液显______性,用离子方程式解释原:______.
(6)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为:______.
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:______.
(8)以N2、H2 为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com