
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
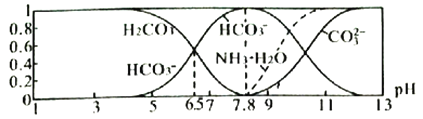
A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
【答案】B
【解析】分析:A项,由NH3·H2O的分布分数的变化分析NH4+的分布分数的变化,再结合图像判断当pH=9时,溶液中各离子浓度大小;B项,根据碳酸氢铵溶液pH=7.8,判断NH4+与HCO3-的大小关系,结合物料守恒解决该项;C项,结合图像判断滴入氢氧化钠溶液后NH4+和HCO3-浓度变化;D项,利用图像中的特殊点(如pH=6.5时)对应的离子浓度,计算水解平衡常数Kh(HCO3-)。
详解:A项,由图像可得,pH=9时,溶液中c(HCO3-)>c(NH3·H2O)>c(CO32-),又因为含氮微粒为NH4+和NH3·H2O,所以NH4+和NH3·H2O的分布分数之和应等于1,所以当pH=9时,溶液中存在关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),故A错误;B项,根据物料守恒,NH4HCO3溶液中存在:①c(NH4+)+c(NH3·H2O)=c(H2CO3)+c(HCO3-)+c(CO32-),又因为0.1mol·L-1NH4HCO3溶液,pH=7.8,所以Kh(NH4+)<Kh(HCO3-),因此c(NH4+)>c(HCO3-),再结合①式可得:c(NH3·H2O)<c(H2CO3)+c(CO32-),即![]() <1,故B正确;C项,根据图像可知,当溶液pH增大时,NH3·H2O浓度逐渐增大,则NH4+的浓度逐渐减小,而HCO3-浓度先增大后减小,故C错误;D项,Kh(HCO3-)=
<1,故B正确;C项,根据图像可知,当溶液pH增大时,NH3·H2O浓度逐渐增大,则NH4+的浓度逐渐减小,而HCO3-浓度先增大后减小,故C错误;D项,Kh(HCO3-)=![]() ,如图常温下当pH=6.5时,c(HCO3-)=c(H2CO3),c(OH-)=Kw/c(H+)=10-14/10-6.5=10-7.5=
,如图常温下当pH=6.5时,c(HCO3-)=c(H2CO3),c(OH-)=Kw/c(H+)=10-14/10-6.5=10-7.5=![]() ×10-8,将数据代入上式得:Kh(HCO3-)=
×10-8,将数据代入上式得:Kh(HCO3-)=![]() ×10-8,常温下水解平衡常数Kh(HCO3-)的数量级为10-8,故D错误。综上分析,符合题意的选项为B。
×10-8,常温下水解平衡常数Kh(HCO3-)的数量级为10-8,故D错误。综上分析,符合题意的选项为B。


科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁溶液中存在下列平衡:FeCl3+3H2O![]() Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是___;基态硫原子的价电子排布式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____(填化学式)。1 mol CN-中含有的π键的数目为____。
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是_____;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______(填元素符号)。
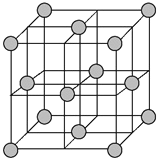
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=___g·cm-3(列出计算式即可)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )
pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )

①m+n<p ②x点的状态是v正>v逆 ③n>p ④x点比y点的反应速度慢 ⑤若升高温度,该反应的平衡常数增大
A. ①②④ B. ②④
C. ③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
I. CO2可用来合成低碳烯烃。
2CO2(g) +6H2(g)![]() CH2 =CH2(g) +4H2O(g) ΔH= a kJ/mol
CH2 =CH2(g) +4H2O(g) ΔH= a kJ/mol
请回答:
(1)已知:H2和CH2 =CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O(1) ΔH = -44.0kJ/mol,则 a=____________kJ/mol。
H2O(1) ΔH = -44.0kJ/mol,则 a=____________kJ/mol。
(2)上述由CO2合成CH2 =CH2的反应在__________下自发进行(填“高温”或“低温”),理由是___________________。
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_________。
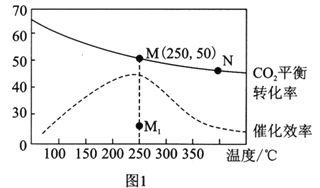
A.平衡常数大小:KM>KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为VL的恒容容器中以n(H2)∶n(CO2) = 3∶1的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象_________。
随时间变化的图象_________。
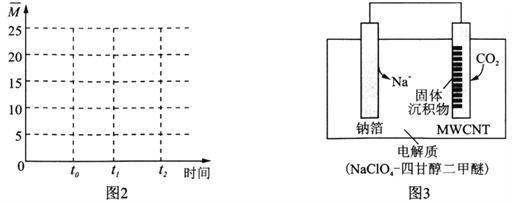
II .利用“ Na—CO2”电池将CO2变废为宝。
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
(5)放电时,正极的电极反应式为______________________。
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol e-时,两极的质量差为_________g。
(7)选用髙氯酸钠—四甘醇二甲醚做电解液的优点是___________________________(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
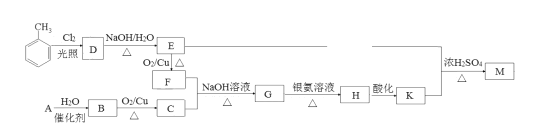
已知:①气态烃A在标准状况下的密度是1.25g/L;
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
RCH2-CHO+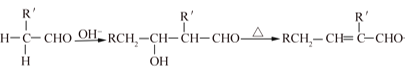 +H2O
+H2O
请回答下列问题:
(1)F的名称是____;G中含有的官能团名称是____。
(2)写出D→E的化学方程式___。
(3)A→B的反应类型是___;M的结构简式是____。
(4)同时满足下列条件的K的同分异构体有___种(不考虑立体异构)。
①遇FeCl3溶液发生显色反应②能发生银镜反应③除苯环以外不再含有其他环状结构
其中核磁共振氢谱为五组峰的结构简式为___。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)( )
A. 0.448LB. 0.672LC. 0.896LD. 0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:________、__________。
(2)有下列五种烃:①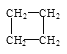 ②
②![]() ③乙烷④正戊烷⑤
③乙烷④正戊烷⑤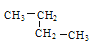 ⑥
⑥![]() ,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
(3)某芳香烃的分子式为C8H10,它可能有的同分异构体共 _______种,其中________(结构简式)在苯环上的一溴代物只有两种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com