
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
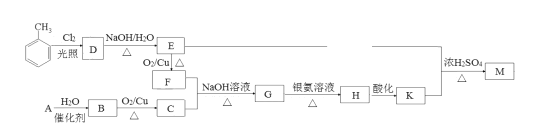
已知:①气态烃A在标准状况下的密度是1.25g/L;
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
RCH2-CHO+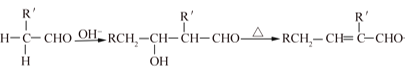 +H2O
+H2O
请回答下列问题:
(1)F的名称是____;G中含有的官能团名称是____。
(2)写出D→E的化学方程式___。
(3)A→B的反应类型是___;M的结构简式是____。
(4)同时满足下列条件的K的同分异构体有___种(不考虑立体异构)。
①遇FeCl3溶液发生显色反应②能发生银镜反应③除苯环以外不再含有其他环状结构
其中核磁共振氢谱为五组峰的结构简式为___。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。___
【答案】苯甲醛 碳碳双键和醛基 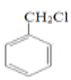 +NaOH
+NaOH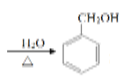 +NaCl 加成反应
+NaCl 加成反应 ![]() 16
16 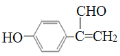 CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHO
CH3CH=CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH![]() CH3CH2CH=CH2
CH3CH2CH=CH2
【解析】
根据气态烃A的密度计算相对分子质量为1.25×22.4=28,得出A为CH2=CH2;A与水发生加成反应生成B (CH3CH2OH);B氧化生成C(CH3CHO);甲苯与氯气发生取代反应生成D(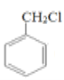 );D发生水解反应生成E(
);D发生水解反应生成E( );E催化氧化生成F(
);E催化氧化生成F(![]() );F与C发生题干条件②的反应生成G(
);F与C发生题干条件②的反应生成G(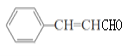 );G发生银镜反应生成H(
);G发生银镜反应生成H(![]() );H酸化生成K(
);H酸化生成K(![]() );E与K发生酯化反应生成M(
);E与K发生酯化反应生成M(![]() ),据此分析问题。
),据此分析问题。
(1)根据上面分析,F为![]() ,名称是苯甲醛;G为
,名称是苯甲醛;G为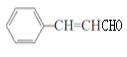 ,含有的官能团名称是碳碳双键和醛基;
,含有的官能团名称是碳碳双键和醛基;
(2)D(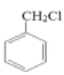 )发生碱性条件下发生水解反应生成E(
)发生碱性条件下发生水解反应生成E(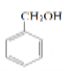 ),化学方程式
),化学方程式 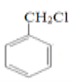 +NaOH
+NaOH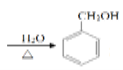 +NaCl;
+NaCl;
(3)A(![]() );
);
(4)①遇FeCl3溶液发生显色反应,必有酚羟基②能发生银镜反应,必有醛基③除苯环以外不再含有其他环状结构,同时满足下列条件的K(![]() )的同分异构体有16种,分别为:(1)三种官能团-OH、-CH=CH2、-CHO连接苯环,共10种;(2)两种官能团-OH、-CH=CHCHO连接苯环,共3种;(3)两种官能团-OH、-C(CHO)=CH2连接苯环,共三种。其中核磁共振氢谱为五组峰的结构简式为
)的同分异构体有16种,分别为:(1)三种官能团-OH、-CH=CH2、-CHO连接苯环,共10种;(2)两种官能团-OH、-CH=CHCHO连接苯环,共3种;(3)两种官能团-OH、-C(CHO)=CH2连接苯环,共三种。其中核磁共振氢谱为五组峰的结构简式为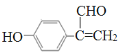 ;
;
(5)根据题干信息可知,可利用醛与醛的反应增长碳链,因此设计路线为CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHO
CH3CH=CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH![]() CH3CH2CH=CH2。
CH3CH2CH=CH2。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料,由A制备聚乙烯醇缩丁醛和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
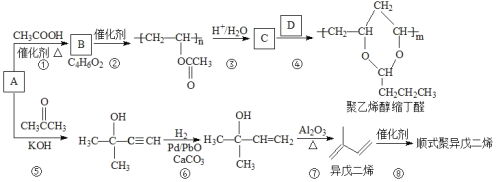
回答下列问题:
(1)A的名称是____________,B含有的官能团是____________。
(2)①的反应类型是___________。
(3)D的结构简式为_____________。
(4)反应③的化学方程式是______________________________________。
(5)异戊二烯分子中最多有_______个原子共平面。写出与A具有相同官能团的异戊二烯的所有同分异构体_________________________________________(填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3 ![]() HCO3-+ Na+
HCO3-+ Na+
B. CH3COONH4:CH3COONH4 = NH4++CH3COO-
C. NaHSO4:NaHSO4 = Na+ +HSO4-
D. Fe(OH)3:Fe(OH)3 ![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
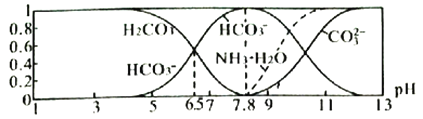
A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是
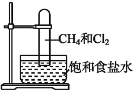
A. 此反应无光照也可发生
B. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出醋酸的电离方程式:_____________________________________;
(2)写出醋酸电离平衡常数表达式:_______________;
(3)向0.1mol/L 醋酸溶液中加入水,电离平衡向_______移动 (填“左”或“右”) ;n(CH3COOH)_______; c(CH3COO-)/c(H+)_______(填“增大”、“减小”或“不变”);
(4)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a___b;生成H2的量a____b;完全中和这两种酸,消耗NaOH的量a___b(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇结构式为 ,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是
,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是
A. 与钠反应时断裂①键 B. 发生消去反应时断裂②④键
C. 发生催化脱氢反应时断裂①③键 D. 与乙酸发生酯化反应时断裂②键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com