
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A.离子键 B.σ键 C.π键 D.配位键 E.范德华力
(4)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=____g/cm3。

【答案】X-射线衍射 ![]() V型 H2O NH2- F>N>O>B sp3 ABD
V型 H2O NH2- F>N>O>B sp3 ABD ![]()
【解析】
(1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)Sb的价电子为5s能级上2个电子、5p能级上3个电子;
[H2F]+与H2O、NH2-等互为等电子体,结构相似;
(3)①涉及的第二周期元素有B、N、O、F元素,第二周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
②[B(OH)4]-中B原子价层电子对个数是4,根据价层电子对互斥理论判断B原子杂化类型;
③NH4BF4中阴阳离子之间存在离子键,N原子和H原子之间存在共价键且其中一个是配位键,B原子和F原子之间存在共价键且其中一个是配位键,共价单键为σ键;
(4)先根据均摊方法确定晶胞中含有的As、Ni原子个数,在计算晶胞的体积,最后根据![]() 计算。
计算。
(1)从外观无法区分三者,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无X射线衍射现象即可确定;
(2)Sb的价电子为5s能级上2个电子、5p能级上3个电子,所以其价电子轨道式为![]() ;
;
[H2F]+与H2O、NH2-等互为等电子体,结构相似,为V形;
(3)①涉及的第二周期元素有B、N、O、F元素,第二周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族元素的原子核外处于其轨道的全充满稳定状态、第VA族元素原子核外电子处于其轨道的半充满的稳定状态,因此它们的第一电离能大于相邻元素,B、N、O、F分别位于第IIIA族、第VA族、第VIA族、第VIIA族,所以第一电离能大小顺序为F>N>O>B;
②[B(OH)4]-中B原子价层电子对个数是4,根据价层电子对互斥理论判断B原子杂化类型为sp3杂化;
③NH4BF4中阴、阳离子之间存在离子键,N原子和H原子之间存在共价键结合且其中有一个是配位键,B原子和F原子之间存在共价键且其中一个是配位键,共价单键为σ键,所以四氟硼酸铵中存在离子键、σ键、配位键,故合理选项是ABD;
(4)根据砷镍合金的晶胞示意图可知该晶胞中As原子个数是2、Ni原子个数=4×![]() +4×
+4×![]() +2×
+2×![]() +2×
+2×![]() =2,其体积=(a×10-10cm×a×10-10cm×
=2,其体积=(a×10-10cm×a×10-10cm×![]() )×c×10-10 cm=
)×c×10-10 cm=![]() a2c×10-30cm3,晶胞密度ρ=
a2c×10-30cm3,晶胞密度ρ= g/cm3=
g/cm3=![]() g/cm3。
g/cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。试回答:
(1)烃A的分子式为________。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简为_____________。
(3)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______________。
(4)比烯烃A少2个碳原子的同系物有________种同分异构体(不考虑顺反异构),其中能和H2发生加成反应生成2-甲基丙烷的烯烃的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是
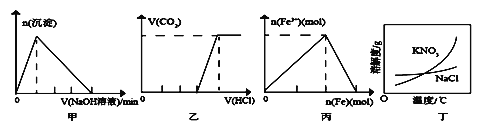
A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al | |
罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | - | - | - | 其余 |
罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | - | 0.1 | 0.25 | 其余 |
拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
(实验仪器与药品)
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H5IO6,弱酸)
(实验方案)
实验预处理。将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
(实验过程)分别向试管a、b中加入少量上述易拉罐片,进行如下操作:

请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有______________________________。
(2)沉淀A的成分为________。
(3)操作③观察到的现象为_____________________________________;反应的离子方程式为____________________________________________。
(4)若试管a、b中取样量相等,则分别加入过量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)________V(b)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。_______
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。

(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:C2H5CH=CHCH3+CH2=CH2![]() C2H5CH=CH2+CH2=CHCH3
C2H5CH=CH2+CH2=CHCH3
现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:

(1)按系统命名法,有机物A的名称是_______。
(2)B的结构简式是__________。
(3)C![]() D的反应类型是___________。
D的反应类型是___________。
(4)写出D![]() M的化学方程式________。
M的化学方程式________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_______。
(6)满足下列条件的X的同分异构体共有_______种,写出任意一种的结构简式_________。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
(7)写出E![]() F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式
沉淀固体B___;C___;E___
(3)写出①、④四个反应方程式(是离子反应的写离子方程式)
①___;④___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:
=10-12的溶液中:![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
B.滴加KSCN溶液显红色的溶液中:![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、![]()
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:

(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是____。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是_____。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是____。
(4)Zn还原SiCl4的反应如下:
反应1: 400℃~756℃ ,SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(l) ΔH1<0
Si(s) + 2ZnCl2(l) ΔH1<0
反应2: 756℃~907℃ ,SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(g) ΔH2<0
Si(s) + 2ZnCl2(g) ΔH2<0
反应3: 907℃~1410℃,SiCl4(g) + 2Zn(g)![]() Si(s) + 2ZnCl2(g) ΔH3<0
Si(s) + 2ZnCl2(g) ΔH3<0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是____。
③ 已知Zn(l)=Zn(g) ΔH = +116 KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com