
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)B的基态原子核外电子排布式为____________________。
(2)BF3的立体构型是_____________________;HF能与BF3化合得到HBF4,从化学键形成角度分析HF与BF3能化合的原因___________。
(3)H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4]-,H3BO3 和[B(OH)4]-中B的杂化轨道类型分别为为____________ 、____________。
(4)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_____________,其中三种元素的电负性由大到小的顺序是__________________________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O,其结构如图所示,
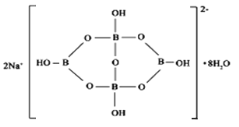
它的阴离子可形成链状结构,则该晶体中不存在的作用力是_________(填选项字母)。
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
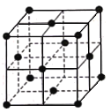
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图所示,其堆积方式为____________,Li+占据阴离子组成的所有最小正四面体中心,该化合物的化学式为____________(用最简整数比表示)。假设晶胞边长为a pm,用NA代表阿伏加德罗常数的值,则该晶胞的密度为___________g/cm3(用含a,NA的代数式表示) 。
【答案】1s22s22p1 平面(正)三角形 BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键 sp2杂化 sp3杂化  H>B>Na D 面心立方最密堆积 LiB6H6 6.32×1032 /(a3·NA)
H>B>Na D 面心立方最密堆积 LiB6H6 6.32×1032 /(a3·NA)
【解析】
(1)B元素处于第二周期IIIA族,核外电子排布式为1s22s22p1 。
故答案为1s22s22p1
(2)BF3分子的中心B原子孤电子对数=![]() =0,价层电子对数=3+0=3,分子空间构型为平面正三角形,中心B原子的杂化轨道类型为sp2,故BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键得到HBF4。
=0,价层电子对数=3+0=3,分子空间构型为平面正三角形,中心B原子的杂化轨道类型为sp2,故BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键得到HBF4。
故答案为 平面(正)三角形 BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键
(3)H3BO3中B原子的价层电子对数为3,故B原子的杂化轨道类型为SP2,[B(OH)4]-中B原子的价层电子数为4,孤对电子数为0,故B原子的杂化轨道类型为SP3杂化。
故答案为 sp2杂化 sp3杂化
(4)NaBH4为离子化合物,电子式为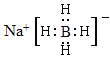 ,NaBH4中H的化合价为-1,电负性大于B,故电负性大小比较为:H>B>Na。
,NaBH4中H的化合价为-1,电负性大于B,故电负性大小比较为:H>B>Na。
故答案为 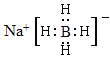 H>B>Na
H>B>Na
(5)Na2[B4O5(OH)4]·8H2O中含有离子键,形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键,图1中用“→”标出其中的配位键为: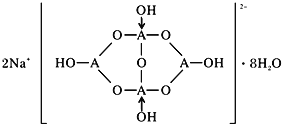 ,该阴离子通过氢键相互结合形成链状结构,故含有共价键、氢键及范德华力的作用,不存在金属键。
,该阴离子通过氢键相互结合形成链状结构,故含有共价键、氢键及范德华力的作用,不存在金属键。
故答案选D
(6)由图可知阴离子处于晶胞的顶点和面心,属于面心立方最密堆积,顶点阴离子与面心阴离子构成正四面体结构,晶胞中有8个正四面体故有8个Li+,故该化合物的化学式为LiB6H6,晶体密度=晶胞的密度=![]() 。
。
故答案为 LiB6H6 6.32×1032 /(a3·NA)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“●”代表一种元素,其中A代表氢元素。
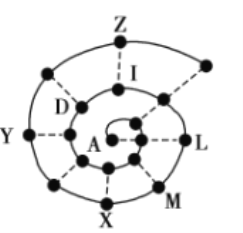
(1)X的元素符号为______,I元素在周期表中的位置为______。
(2)M与Z两种元素形成的化合物的化学式为______。
(3)下列说法正确的是______(填序号)。
a.I元素形成的单质通入LZ的溶液中可得Z元素形成的单质
b.虚线相连的元素处于同一主族
c.L元素形成的单质在D元素形成的单质中燃烧生成![]()
d.X、Y、M元素为同周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g)![]() CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =________。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
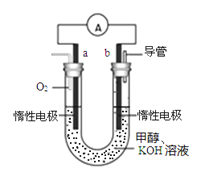
①该电池工作时,负极是_______极(填“a”或 “b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为_________________。
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq)![]() 2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
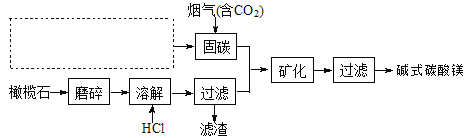
①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为_____________。
②在上图虚框内补充一步工业生产流程______________。
③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,e、g、h、i、j均是由这些元素组成的二元化合物,i常温常压下为液体,其余均为无色气体。e的摩尔质量为g的2倍,f是元素Z的单质,g物质能使湿润的红色石蕊试纸变蓝,h的组成元素位于同一主族。上述物质的转化关系如图所示。下列说法正确的是
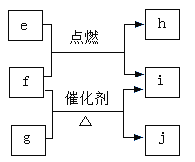
A.原子半径:Y>Z>W>XB.热稳定性:i>g, 沸点:i>e
C.Y与W的含氧酸均是强酸D.h与j均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有几种元素的微粒的电子层结构为 ,试回答下列问题:
,试回答下列问题:
(1)若该微粒代表一种原子,则这种微粒的符号是______;
(2)向该微粒(带负电荷)的盐溶液中加入![]() 溶液时会出现白色沉淀,则这种微粒的符号是______;
溶液时会出现白色沉淀,则这种微粒的符号是______;
(3)某原子失去一个电子形成该微粒,则这种微粒的符号是______;
(4)某原子得到两个电子形成该微粒,则这种微粒的符号是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
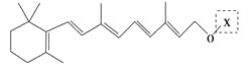
为了研究X的结构,将化合物A在一定条件下水解只得到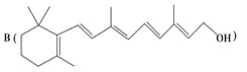 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。
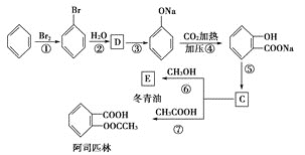
(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mLAl2(SO4)3溶液中,含Al3+1.62 g,在该溶液中加入0.1molL﹣1Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
A. 0.4molL﹣1B. 0.3molL﹣1C. 0.2molL﹣1D. 0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com