
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“●”代表一种元素,其中A代表氢元素。
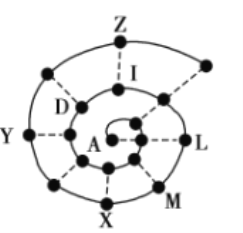
(1)X的元素符号为______,I元素在周期表中的位置为______。
(2)M与Z两种元素形成的化合物的化学式为______。
(3)下列说法正确的是______(填序号)。
a.I元素形成的单质通入LZ的溶液中可得Z元素形成的单质
b.虚线相连的元素处于同一主族
c.L元素形成的单质在D元素形成的单质中燃烧生成![]()
d.X、Y、M元素为同周期元素
【答案】Al 第二周期ⅦA族 MgCl2 d
【解析】
A点代表H,按照原子序数由小到大由里往外延伸,由图可知,D为O、I为F、L为Na、M为Mg、X为Al、Y为P,Z为Cl,虚线连接的原子处于同主族,据以上分析解答。
(1)X的原子序数为13,为![]() 元素;
元素;![]() 的原子序数为9,为F元素,在元素周期表的第二周期ⅦA族;
的原子序数为9,为F元素,在元素周期表的第二周期ⅦA族;
(2)M是![]() 元素、Z是
元素、Z是![]() 元素,二者形成离子化合物
元素,二者形成离子化合物![]() ;
;
(3)a.L是Na元素,![]() 与
与![]() 溶液反应时,
溶液反应时,![]() 直接与H2O直接反应,不能得到
直接与H2O直接反应,不能得到![]() ,a项错误;
,a项错误;
b.虚线相连的元素处于同一族,图中包含主族和0族元素,不全部是主族元素,b项错误;
c.D是![]() 元素,
元素,![]() 在
在![]() 中燃烧生成
中燃烧生成![]() ,不是
,不是![]() ,c项错误;
,c项错误;
d.Y是![]() 元素,
元素,![]() 、
、![]() 、
、![]() 都是第三周期元素,d项正确;
都是第三周期元素,d项正确;
故答案选d。


科目:高中化学 来源: 题型:
【题目】请按要求填空:
(1)简单原子的原子结构可用下图形象地表示:

其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是__
A.①②③是三种不同的核素
B.①②③具有相同的质量数
C.①②③互为同位素
D.①②③是三种化学性质不同的粒子
(2)科学家已发现一种新型氢分子(H3),在相同条件下,等质量的H3和H2相同的是__
A 分子数 B 原子数 C 体积 D 电子数
(3)微粒AXn+ 核外有a个电子,则它的核内中子数为______
(4)与10克D2O含有相同电子数的NH3在标准状况下的体积是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:___。
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式:
___V2O5+___Al![]() ___Al2O3+___V
___Al2O3+___V
该反应中氧化剂是___,要得到1mol金属钒,需要纯铝的质量___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.与![]() 互为同分异构体的芳香化合物有6种
互为同分异构体的芳香化合物有6种
C.C5H12的一氯代物有8种
D.菲的结构简式为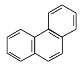 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种溶液分别含有下列十种离子中的各不相同的五种:H+、Al3+、Na+、Cu2+、![]() 、OH-、
、OH-、![]() 、
、![]() 、
、![]() 、Cl-。下列判断正确的是( )
、Cl-。下列判断正确的是( )
A.若A溶液为无色溶液,则A溶液中可能含有:H+、Al3+、Cl-、![]() 、
、![]()
B.若A溶液有强还原性,则B溶液中可能含有:H+、Cu2+、Al3+、Cl-、![]()
C.若B溶液呈强碱性,则A溶液中可能含有:H+、Al3+、Na+、Cu2+、![]()
D.若B溶液有强氧化性且各离子浓度相同,则B溶液可能含有:H+、Al3+、Cu2+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铜和含有2.4×10-3mol硝酸的某浓硝酸完全反应,共收集到标准状况下气体体积22.4 mL。参加反应的铜的质量是( )
A. 38.4×10-3gB. 44.8×10-3gC. 48.3×10-3gD. 57.6×10-3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗禽流感药物达菲可用莽草酸为原料来合成。莽草酸结构简式如图所示。下列说法正确的是

A.莽草酸的化学式为C7H6O5
B.1mol莽草酸最多能和4molNaOH发生反应
C.莽草酸分子中所有碳原子共平面
D.莽草酸在一定条件下可以发生取代、加成、消去、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式______.
(2)含硫各微粒(H2SO3、![]() 和
和![]() )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
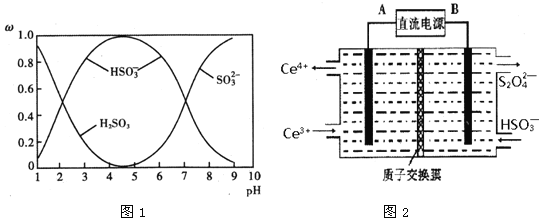
①下列说法正确的是______(填标号).
A.pH=7时,溶液中c(Na+)=3c(![]() )
)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(![]() )+c(H2SO3)
)+c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为______.
③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定,酸性高锰酸钾溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是______
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为______.
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为______ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)B的基态原子核外电子排布式为____________________。
(2)BF3的立体构型是_____________________;HF能与BF3化合得到HBF4,从化学键形成角度分析HF与BF3能化合的原因___________。
(3)H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4]-,H3BO3 和[B(OH)4]-中B的杂化轨道类型分别为为____________ 、____________。
(4)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_____________,其中三种元素的电负性由大到小的顺序是__________________________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O,其结构如图所示,
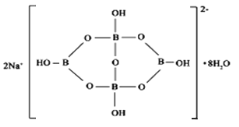
它的阴离子可形成链状结构,则该晶体中不存在的作用力是_________(填选项字母)。
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
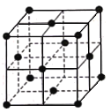
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图所示,其堆积方式为____________,Li+占据阴离子组成的所有最小正四面体中心,该化合物的化学式为____________(用最简整数比表示)。假设晶胞边长为a pm,用NA代表阿伏加德罗常数的值,则该晶胞的密度为___________g/cm3(用含a,NA的代数式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com