
【题目】有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
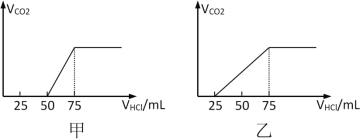
试分析NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是什么?其物质的量之比是多少?__________产生的CO2气体体积(标况)是多少?____________
【答案】NaOH、Na2CO3 1:1;Na2CO3、NaHCO3 1:1; 56mL;112mL
【解析】
当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。
(1)(甲)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(乙)中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3,根据反应消耗盐酸的体积计算NaHCO3、Na2CO3的物质的量之比;
(2)根据碳元素守恒可知,(甲)中从50mL~75mL消耗25mL盐酸时生成的二氧化碳,而(乙)中从25mL~75mL消耗50mL盐酸时生成的二氧化碳,根据方程式进而计算生成二氧化碳的体积。
(1)(甲)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1;(乙)中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3, Na2CO3转化为NaHCO3消耗盐酸体积为25mL,则原溶液中NaHCO3消耗盐酸体积50mL-25mL=25mol,故NaHCO3、Na2CO3的物质的量之比=25mL:25mL=1:1,故答案为:NaOH、Na2CO3,1:1;NaHCO3、Na2CO3,1:1;
(2)根据碳元素守恒可知,(甲)中从50mL~75mL消耗25mL盐酸时生成的二氧化碳,该阶段生成二氧化碳为0.025L×0.1mol·L-1=0.0025mol,体积为0.0025mol×22.4L·mol-1=0.056L=56mL,而(乙)中从25mL~75mL消耗50mL盐酸时生成的二氧化碳,该阶段生成二氧化碳为0.05L×0.1mol·L-1=0.005mol,体积为0.005mol×22.4L·mol-1=0.112L=112mL,故答案为:56;112。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学习探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
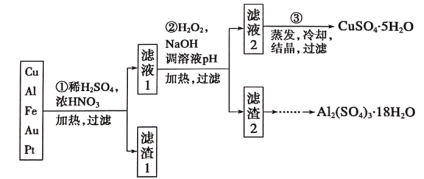
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_________;
得到滤渣I的主要成分为____________________;
(2)第②步加H2O2的作用是__________________;
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________;
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
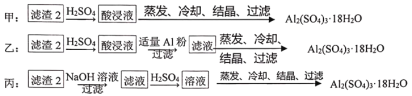
上述三种方案中,___方案不可行,原因是_____;从原子利用率角度考虑,___方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 四种元素,
四种元素,![]() 元素是地壳中含量最多的金属元素;
元素是地壳中含量最多的金属元素;![]() 元素的原子其
元素的原子其![]() 层(有电子)电子数比
层(有电子)电子数比![]() 层少1;
层少1;![]() 元素的原子得到2个电子和
元素的原子得到2个电子和![]() 元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中![]() 元素的名称是______。
元素的名称是______。
(2)画出![]() 元素原子的结构示意图:____________。
元素原子的结构示意图:____________。
(3)写出下列化学方程式。
①单质![]() 在单质
在单质![]() 中燃烧:__________________;
中燃烧:__________________;
②![]() 的氢氧化物和
的氢氧化物和![]() 的氢氧化物在溶液中反应:________________________。
的氢氧化物在溶液中反应:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为![]() ,原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
,原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
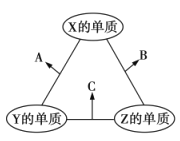
A.X元素位于ⅥA族
B.A不能溶解于B中
C.B的稳定性强于C
D.A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡萝卜中具有较多的胡萝卜素,它是人体主要营养之一,α-胡萝卜素的结构为: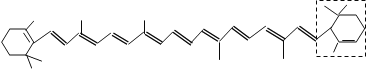 。有机化学中有时可以将结构简式中的C和H省略不写,如
。有机化学中有时可以将结构简式中的C和H省略不写,如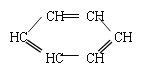 可写为:
可写为:![]() ;又如
;又如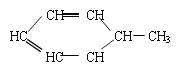 可写为:
可写为:![]() 。
。
(1)写出α-胡萝卜素的化学式______________。
(2)1mol胡萝卜素最多能与__________molBr2发生加成反应。
(3)β-胡萝卜素与α-胡萝卜素互为同分异构体,且只是虚线框内部分不同,但碳架结构相同,写出β-胡萝卜素虚线框内可能的结构简式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素,且原子序数依次递增。
为短周期元素,且原子序数依次递增。![]() 、
、![]() 同主族,
同主族,![]() 、
、![]() 同主族。
同主族。![]() 与其他非金属元素化合时易形成共价键,
与其他非金属元素化合时易形成共价键,![]() 与其他非金属元素化合时易形成离子键,且离子
与其他非金属元素化合时易形成离子键,且离子![]() 与
与![]() 的核外电子排布相同。气态分子
的核外电子排布相同。气态分子![]() 和
和![]() 具有相同的电子数,
具有相同的电子数,![]() 是空气中含量最高的物质。请回答下列问题:
是空气中含量最高的物质。请回答下列问题:
(1)![]() 位于第______周期______族;
位于第______周期______族;
(2)![]() 的简单离子结构示意图为______;
的简单离子结构示意图为______;
(3)![]() 的电子式是______;
的电子式是______;
(4)由![]() 、
、![]() 、
、![]() 三种元素形成的化合物的化学式为______,含有的化学键类型有______,属于______(填“共价”或“离子”)化合物。
三种元素形成的化合物的化学式为______,含有的化学键类型有______,属于______(填“共价”或“离子”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:

回答下列问题:
(l) Li的原子结构示意图为____,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要____。
(6)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com