
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 四种元素,
四种元素,![]() 元素是地壳中含量最多的金属元素;
元素是地壳中含量最多的金属元素;![]() 元素的原子其
元素的原子其![]() 层(有电子)电子数比
层(有电子)电子数比![]() 层少1;
层少1;![]() 元素的原子得到2个电子和
元素的原子得到2个电子和![]() 元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中![]() 元素的名称是______。
元素的名称是______。
(2)画出![]() 元素原子的结构示意图:____________。
元素原子的结构示意图:____________。
(3)写出下列化学方程式。
①单质![]() 在单质
在单质![]() 中燃烧:__________________;
中燃烧:__________________;
②![]() 的氢氧化物和
的氢氧化物和![]() 的氢氧化物在溶液中反应:________________________。
的氢氧化物在溶液中反应:________________________。
【答案】氧 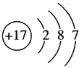
![]()
![]()
【解析】
A、B、C、D四种元素,A元素是地壳中含量最多的金属元素,故A为Al元素;B元素的原子其M层电子数比L层少1个电子,故M层电子数为8-1=7,故B为Cl元素;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构,故C原子核外电子数为10-2=8,为O元素,D元素原子核外电子数为10+1=11,故D为Na元素,据此分析解答。
(1)由上述分析可知,C为氧元素;
(2)B为氯元素,原子序数为17,核内有17个质子,核外电子数为17,有3个电子层,最外层电子数为7,原子结构示意图 ;
;
(3)钠在氧气中燃烧生成过氧化钠,化学方程式为:![]() ;A的氢氧化物为氢氧化铝,D的氢氧化物为氢氧化钠,反应生成偏铝酸钠和水,反应的离子方程式为:
;A的氢氧化物为氢氧化铝,D的氢氧化物为氢氧化钠,反应生成偏铝酸钠和水,反应的离子方程式为:![]() 。
。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_____。
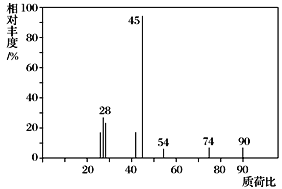
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是__________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为 ( )
A.1∶1B.2∶1C.3∶1D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的△H=-163kJ/mol,1molN2(g),1molO2(g)分子中化学键断裂时分别需要吸收945kJ,498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20min时段,反应速率v(N2O)为___molL-1min1。
②若N2O起始浓度c0为0.150 molL-1,则反应至30min时N2O的转化率α=___。比较不同起始浓度时N2O的分解速率:v(c0=0.150molL-1)___v(c0=0.001molL-1)(填“>”、“=”或“<”)。
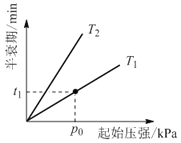
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1____T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) ![]() 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=kc(N2O)[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.N2O分解反应中,k(含碘)>k(无碘)
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2浓度与N2O分解速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药)。因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
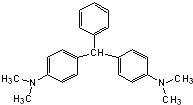
A.分子中所有的碳原子可能在同一平面上
B.无色孔雀石绿与氢气完全加成后的产物的核磁共振氢谱中有7个峰
C.无色孔雀石绿可与溴水中的溴发生加成反应
D.在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
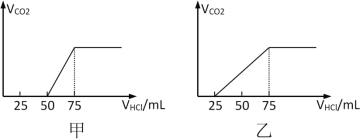
试分析NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是什么?其物质的量之比是多少?__________产生的CO2气体体积(标况)是多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校实验小组的同学利用下图所示实验装置探究氨与氧化铜的反应(图中夹持、固定装置均略去)。
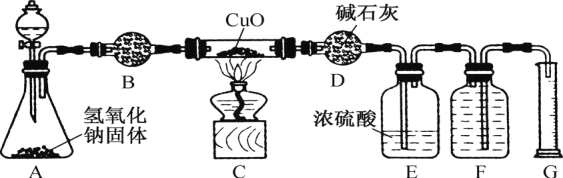
(1)按图设计组装好仪器,先__________________,再装入药品。
(2)A中分液漏斗内应装_________________ ,B中固体试剂为__________________。
(3)打开分液漏斗活塞,加入试剂,点燃C处的酒精灯,一段时间后,观察到C中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质。写出装置C中反应的化学方程式:______。
(4)E中浓硫酸的作用是__________________。
(5)用平衡移动原理解释A中产生气体的原因__________________________ 。(用相关的离子方程式和必要的文字描述)
(6)已知Cu2O也是红色的。下表为实验前后C装置的质量,通过计算可知反应后的产物中______ (填“有”、“无”或“无法确定”)Cu2O。
空玻璃管 | 实验前(样品+玻璃管) | 实验后(样品+玻璃管) |
59.60 g | 65.60g | 64.64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯制备溴苯___________________。
(2)制备TNT_____________________。
(3)2溴丙烷消去反应______________。
(4)实验室制乙烯__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com