
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该溶液中钾离子浓度为( )
A.0.1(b-2a)mol·L-1 B.10(2a-b)mol·L-1
C.10(b-a)mol·L-1 D.10(b-2a)mol·L-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是 ( )
A.原溶液中的Br-一定被氧化 B.通入氯气之后原溶液中的Fe2+不一定被氧化
C.不能确定通入氯气之后的溶液中是否存在Fe2+
D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,一定能产生黄色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
 (2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
 __Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
__Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
(3)某锂离子电池用含有Li+的导电固体作为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料C6中,以LiC6表示,电池反应为CoO2+LiC6  LiCoO2+C6。放电时的正极反应式为___________。右图表示该装置工作时电子和离子的移动方向,此时C6电极作____极。
LiCoO2+C6。放电时的正极反应式为___________。右图表示该装置工作时电子和离子的移动方向,此时C6电极作____极。
(4)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ•mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为 _________________________________ 。
(5)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:


①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ调pH的目的是除去Fe3+,其原理是Fe3++3H2O Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K= 。
Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K= 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将甲、乙两种金属的性质相比较,下列不能说明甲的金属性比乙强的是 ( )
A. 甲与水反应比乙与水反应剧烈
B. 甲单质能从乙的盐溶液中置换出单质乙
C. 与某非金属反应时甲原子失电子数目比乙的多
D. 甲的最高价氧化物的水化物比乙的最高价氧化物的水化物碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
为提纯下列物质(括号内为少量杂质),所选用的除杂式试剂和分离方法正确的是( )
| 提纯物质 | 除杂试剂 | 分离法 | |
| A | KCl溶液(FeCl3) | 氨水 | 过滤 |
| B | 乙酸乙酯(乙酸) | 乙醇和浓硫酸 | 分液 |
| C | Fe粉(Al粉) | NaOH溶液 | 过滤 |
| D | 乙醇(H2O) | 金属钠 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验题
“酒是陈的香”的原因之一是储存过程中生成了有香味的酯。
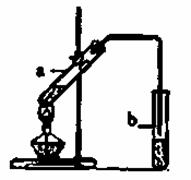 实验室用下图所示装置制取乙酸乙酯。
实验室用下图所示装置制取乙酸乙酯。
①试管a中生成乙酸乙酯的化学反应方程式
是 。
②试管b中盛放的试剂是
溶液,试管b中的导管不伸入 液面下的原
因是 。
试管b中发生反应的化学方程式是 。
③生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
在A2+3B2 = 2C的反应中,经过t秒钟后,C的浓度增加了0.6mol/L,在此期间,反应速率V(B2)=0.45mol/(L·S),则t值为
A. 1秒 B. 1.5秒 C. 2秒 D. 2.5秒
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。

请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。

请回答:a点溶液中所含溶质的化学式为__________ ,a-b之间的反应的离子方程式是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com