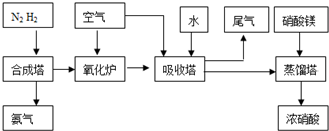
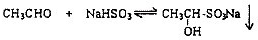��2009?��ɽģ�⣩ij�о���ѧϰС��ѧϰ�˹�ҵ�������Ƽ����ԭ����
[�������]�ܷ���ʵ����ģ�⡰�����Ƽ������ȡNaHCO
3�Ĺ����أ�
[ʵ��ԭ��]д�������Ƽ��Ӧ�Ļ�ѧ����ʽΪ
NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl
��[ʵ����֤]��ͼ�Ǹ�ѧϰС�����ģ��ʵ��ʱ���õ��IJ�����Ҫװ�ã�
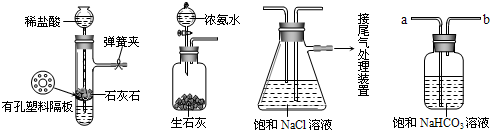
��ش��������⣺
��1������Aװ�������Եķ����ǣ�����������©�����������н����ɼк�©��ע��һ������ˮ��ʹ©���ڵ�ˮ������Թ��ڵ�ˮ�棬ֹͣ��ˮ����
©�������Թ��е�Һ��ˮ�����ֲ��ٱ仯��©���е�Һ��ˮ���治���½���
©�������Թ��е�Һ��ˮ�����ֲ��ٱ仯��©���е�Һ��ˮ���治���½���
��˵��װ�ò�©����
��2��D��������װ��A��װ��C֮������徻��װ�ã���������
a
a
����a��b����D�������dz�ȥ
HCl
HCl
���壮�ɷ�ƿ���Լ���Ϊ̼������Һ
��
��
����ɡ�������
��3��ʵ��ʱ����NaCl��Һ��ͨ��϶��
NH3
NH3
����ͨ��������
CO2
CO2
����ԭ����
��
��
������д��ţ�
��ʹCO
2���ױ����� ��NH
3��CO
2������ȡ ��CO
2���ܶȱ�NH
3��
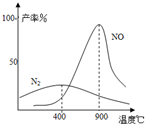
��4����
����
����
�ķ��������ɵ�NaHCO
3����ӻ�����з��������
���Ҫ�Ƶô�����跢���ķ�Ӧ�ǣ�д����Ӧ�Ļ�ѧ����ʽ����
��
[�ó�����]���á������Ƽ����ʵ���ҿ�����ȡNaHCO
3��





 ��2009?��ɽģ�⣩��ҵ�ϳɰ����Ʊ�����һ��������������������£�
��2009?��ɽģ�⣩��ҵ�ϳɰ����Ʊ�����һ��������������������£�