
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是
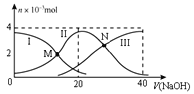
A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =5,则H2A的Ka2数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
【答案】B
【解析】
根据图象知,H2A溶液中存在H2A分子,说明H2A部分电离,所以H2A为弱酸,NaOH溶液体积为20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶液中的溶质主要为NaHA,HA-电离程度大于水解程度,溶液显酸性,NaOH溶液体积为40mL时,发生反应为NaOH+NaHA═Na2A+H2O,反应后得到溶液为Na2A溶液,A2-离子水解溶液显碱性。
A项、由图可知,M点溶液中c(H2A)= c(HA-),由物料守恒可知c(H2A)+c(HA-)+ c(A2-)=![]() <0.2 mol/L,则2c(HA-)+c(A2-) <0.2 mol/L,故A错误;
<0.2 mol/L,则2c(HA-)+c(A2-) <0.2 mol/L,故A错误;
B项、N点溶液中c(HA-)= c(A2-),溶液中存在电荷守恒关系c(Na+)+ c(H+)= c(OH-)+ c(HA-)+2 c(A2-),因溶液呈酸性,溶液中c(OH-)< c(H+),则c(Na+) < 3c(HA-),故B正确;
C项、N点溶液中c(HA-)= c(A2-),H2A的Ka2= = c(H+)=1×10—5,Ka2数量级为105,故C错误;
= c(H+)=1×10—5,Ka2数量级为105,故C错误;
D项、NaOH溶液体积为20 mL时,恰好发生反应为NaOH+H2A═NaHA+H2O,溶液中的溶质为NaHA,由图像可知,此时溶液中n(A2-)>n(H2A),说明HA-电离程度大于水解程度,溶液显酸性,故溶液中c(OH-)< c(H+),D错误。
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和所得结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡 | 溶液红色变浅 | Na2CO3溶液存在水解平衡 |
B | 向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液 | 溶液变为红色 | X溶液中一定含有Fe2+ |
C | 检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验 | 试纸不变蓝 | 该食盐不含有KIO3 |
D | 向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液 | 均有沉淀生成 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
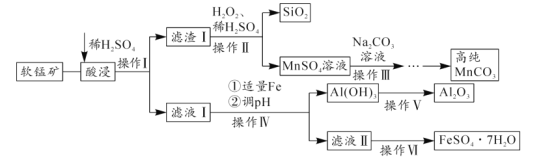
【题目】软锰矿的主要成分为MnO2,还含有SiO2、Al2O3、Fe2O3、FeO等杂质。软锰矿经过综合利用,可制备碳酸锰、氧化铝及绿矾( FeSO47H2O),其制备过程如图:
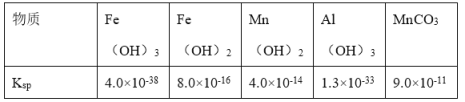
部分物质的Ksp如表:
回答下列问题:
(1)操作I中需要的仪器有______(填字母序号)。
a.蒸发皿 b.酒精灯c.漏斗 d.玻璃棒 e.烧杯
(2)操作Ⅱ中反应的离子方程式为______。
(3)操作Ⅲ中也可用NaHCO3与MnSO4溶液反应制备碳酸锰,其反应的离子方程式为______。
(4)操作Ⅳ中加入适量Fe的目的是______;当调节pH=______时(结果保留整数),可确定Al(OH)3完全沉淀。(已知:完全沉淀后,溶液中离子浓度不高于10-5molL-1)
(5)操作Ⅵ中一般要加入稀硫酸,目的是______,然后______、冷却结晶、______、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
(2)一种熔融碳酸盐燃料电池原理示意如图所示:
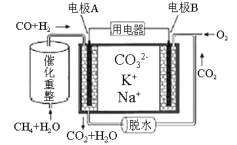
电池工作时,外电路上电流的方向应从电极________(填A或B)流向用电器。内电路中,CO32-向电极___________(填A或B)移动,电极A上CO参与的电极反应为___________。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲醇(CH3OH)和氧气构成燃料电池,则通入甲醇的电极是原电池的____极,该极的电极反应式是____________,通入氧气的电极是原电池的____极,电极反应式是___________________。如果消耗甲醇160 g,假设化学能完全转化为电能,则转移电子的数目为_______________(用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________种运动状态不同的电子,Fe3+基态核外电子排布式为_______________。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________(用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________;HCN中C原子轨道的杂化类型为__________。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________,其中Fe的配位数为_____________。

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,![]() ,
,![]() )、(
)、(![]() ,0,
,0,![]() )和(
)和(![]() ,
,![]() ,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020

(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_______。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是_______。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是_______。
(6)由滤液得到ZnSO47H2O的操作依次为_______、_______、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金废料主要含铁、铜、铝,为从合金废料中得到Fe2O3、Al2O3和金属Cu等产品,某化学兴趣小组按如下工艺流程进行实验(杂质不与稀硫酸反应)。

请回答下列问题:
(1)固体A主要含有的物质是________。
(2)B到C发生反应的离子方程式为________,溶液C中的阳离子主要有________。
(3)若D为NaOH,则溶液E中铝元素的存在形式是________(填化学式)。
(4)灼烧沉淀F时所用主要仪器之一是________(填序号)。
A.蒸发皿 B.烧杯 C.坩埚 D.试管
(5)氮化铝(AlN)陶瓷是一种具有广阔开发前景的高温结构材料,具有高导热率、高电绝缘性、高强度、高硬度、耐腐蚀等优良性能,工业上可通过Al2O3、碳和N2在高温条件下反应得到,同时生成一种常见气体G,若该反应每转移3.01╳1023个电子,有0.25mol气体G生成,则该反应的化学方程式为_________。在工业上Al2O3的用途还有________(任填一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是
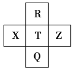
A.气态氢化物的酸性:R>T>Q
B.R与Q的电子数相差16
C.气态氢化物的稳定性:T>X
D.R的单质通入T的钠盐溶液中能置换出T的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com