
【题目】某合金废料主要含铁、铜、铝,为从合金废料中得到Fe2O3、Al2O3和金属Cu等产品,某化学兴趣小组按如下工艺流程进行实验(杂质不与稀硫酸反应)。

请回答下列问题:
(1)固体A主要含有的物质是________。
(2)B到C发生反应的离子方程式为________,溶液C中的阳离子主要有________。
(3)若D为NaOH,则溶液E中铝元素的存在形式是________(填化学式)。
(4)灼烧沉淀F时所用主要仪器之一是________(填序号)。
A.蒸发皿 B.烧杯 C.坩埚 D.试管
(5)氮化铝(AlN)陶瓷是一种具有广阔开发前景的高温结构材料,具有高导热率、高电绝缘性、高强度、高硬度、耐腐蚀等优良性能,工业上可通过Al2O3、碳和N2在高温条件下反应得到,同时生成一种常见气体G,若该反应每转移3.01╳1023个电子,有0.25mol气体G生成,则该反应的化学方程式为_________。在工业上Al2O3的用途还有________(任填一种)。
【答案】Cu或铜 Cl2+2Fe2+=2Cl-+2Fe3+ Fe3+、A13+和H+ NaA1O2 C Al2O3 + N2 + 3C![]() 2AlN + 3CO 冶炼金属铝或作防火材料
2AlN + 3CO 冶炼金属铝或作防火材料
【解析】
铁、铝和硫酸反应生成硫酸亚铁、硫酸铝,铜和硫酸不反应,滤液B中含有硫酸亚铁、硫酸铝,通入足量氯气,Fe2+被氧化为Fe3+,加入过量氢氧化钠溶液,生成氢氧化铁沉淀和偏铝酸钠,偏铝酸钠溶液中通入足量二氧化碳生成氢氧化铝沉淀。
(1) 铁、铝和硫酸反应生成硫酸亚铁、硫酸铝,铜和硫酸不反应,所以固体A主要含有的物质是Cu;
(2) 滤液B中含有硫酸亚铁、硫酸铝和硫酸,通入足量氯气,Fe2+被氧化为Fe3+,发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;溶液C中的阳离子主要有Fe3+、A13+和H+;
(3) 若D为NaOH,A13+和过量氢氧化钠反应生成偏铝酸钠,则溶液E中铝元素的存在形式是NaA1O2;
(4)在坩埚中灼烧固体物质,灼烧氢氧化铁沉淀时所用主要仪器之一是坩埚,选C;
(5)工业上可通过Al2O3、碳和N2在高温条件下反应得到AlN,同时生成一种常见气体G,若该反应每转移3.01╳1023个电子,有0.25mol气体G生成,说明碳的化合价升高为+2,则G是CO,则该反应的化学方程式为Al2O3+ N2+ 3C![]() 2AlN + 3CO;电解熔融氧化铝冶炼金属铝,在工业上用Al2O3冶炼金属铝。
2AlN + 3CO;电解熔融氧化铝冶炼金属铝,在工业上用Al2O3冶炼金属铝。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是
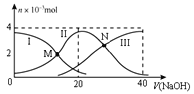
A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =5,则H2A的Ka2数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据见下图,下列说法正确的是

A. Bi元素的质量数是83 B. Bi元素的相对原子质量是209.0
C. Bi原子6p能级有一个未成对电子 D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是
A. 碳原子的轨道表示式:![]() B. 次氯酸分子的电子式:
B. 次氯酸分子的电子式:![]()
C. CH4Si的结构式:![]() D. 质量数为137的钡原子:56137Ba
D. 质量数为137的钡原子:56137Ba
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写不正确的是
A.HNO3=H+ + NO![]() B.Al2(SO4)3=2Al3+ + 3SO
B.Al2(SO4)3=2Al3+ + 3SO![]()
C.Ba(OH)2=Ba2+ + 2OH-D.NaHCO3=Na+ + H+ + CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的化学式_____。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子电子转化成10电子分子的化学方程式____(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________。
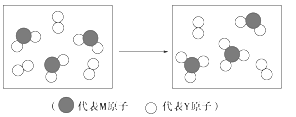
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为____,B的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
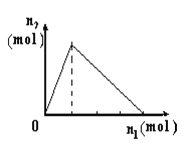
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1molB和1molC, B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中碳原子数相同,且Mr(B)=Mr(C)+2
(1)C的分子式为_____________________,
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式_________________________;
(3)C有多种同分异构体,其中属于芳香族的酯类的同分异构体有_____________种;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com