
【题目】下列有关化学用语正确的是
A. 碳原子的轨道表示式:![]() B. 次氯酸分子的电子式:
B. 次氯酸分子的电子式:![]()
C. CH4Si的结构式:![]() D. 质量数为137的钡原子:56137Ba
D. 质量数为137的钡原子:56137Ba
【答案】A
【解析】
A. 碳原子的核电荷数为6,原子核外电子排布为1s22S22p2,据此写出原子的轨道表示式;
B.为共价分子,根据氢、氯成1键,氧成2键规律可写出次氯酸电子式;
C.根据氢、碳、硅成4键规律可写出CH4Si的结构式;
D. 元素原子的左上角表示质量数,左下角表示质子数;
A. 碳原子的核电荷数为6,原子核外电子排布为1s22S22p2,原子的轨道表示式![]() ,正确;
,正确;
B. 次氯酸为共价分子,根据氢、氯成1键,氧成2键规律可知次氯酸分子的电子式:![]() ,错误;
,错误;
C. CH4Si为共价分子,根据氢成1键、碳、硅成4键规律可知,CH4Si的结构式:![]() ,错误;
,错误;
D. 质量数=质子数+中子数,所以质量数为137、核电荷数为56的钡原子表示方法为![]() ,错误;
,错误;
综上所述,本题正确选项A。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O,相对分子质量286)来配制0.1mol/L的碳酸钠溶液980mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是
A. 称取碳酸钠晶体28.6g
B. 溶解时进行加热,并将热溶液转移到容量瓶中至刻度线
C. 转移时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤
D. 定容后,将容量瓶振荡摇匀,静置发现液面低于刻度线,又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020

(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_______。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是_______。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是_______。
(6)由滤液得到ZnSO47H2O的操作依次为_______、_______、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl26H2O的流程如图:
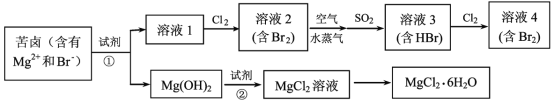
(1)海水淡化的方法有蒸馏法、___(任写一种)等,考虑成本及效益试剂①可选用___。
(2)比较溶液中Br2的浓度:溶液2___溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是__。
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作包括____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金废料主要含铁、铜、铝,为从合金废料中得到Fe2O3、Al2O3和金属Cu等产品,某化学兴趣小组按如下工艺流程进行实验(杂质不与稀硫酸反应)。

请回答下列问题:
(1)固体A主要含有的物质是________。
(2)B到C发生反应的离子方程式为________,溶液C中的阳离子主要有________。
(3)若D为NaOH,则溶液E中铝元素的存在形式是________(填化学式)。
(4)灼烧沉淀F时所用主要仪器之一是________(填序号)。
A.蒸发皿 B.烧杯 C.坩埚 D.试管
(5)氮化铝(AlN)陶瓷是一种具有广阔开发前景的高温结构材料,具有高导热率、高电绝缘性、高强度、高硬度、耐腐蚀等优良性能,工业上可通过Al2O3、碳和N2在高温条件下反应得到,同时生成一种常见气体G,若该反应每转移3.01╳1023个电子,有0.25mol气体G生成,则该反应的化学方程式为_________。在工业上Al2O3的用途还有________(任填一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为准确测定FeSO4的浓度,可用重铬酸钾标准溶液进行滴定。(已知重铬酸钾被还原为Cr3+)
步骤1.用分析天平准确称取2.9400g重铬酸钾,配制500mL重铬酸钾标准溶液;
步骤2.移取25.00mL所配制的重铬酸钾标准溶液于500mL锥形瓶中,用蒸馏水稀释至250mL,再加20mL浓硫酸,冷却后,加2~3滴试亚铁灵指示剂;
步骤3.用待测硫酸亚铁溶液滴定至溶液由橙黄到绿,由绿色刚变为红紫色为终点;
步骤4.记录消耗硫酸亚铁溶液的体积为18.70 mL。
(1)配制500mL重铬酸钾标准溶液需要的玻璃仪器有量筒、烧杯、 ____________________
(2)移取K2Cr2O7溶液选用的仪器是___________,盛装待测硫酸亚铁溶液选用的仪器是___________
A.50mL酸式滴定管 B.25mL碱式滴定管 C.25mL量筒
(3)氧元素位于周期表的______分区,铁元素在周期表中的位置是___________________,Fe2+的简化电子排布式为_________________,基态铬原子的价电子电子排布图为 __________________。
(4)测得FeSO4的浓度为 ______________ 。(小数点后保留两位数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半 B. 均加倍 C. 均增加1mol D. 均减少1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:


已知以下信息:

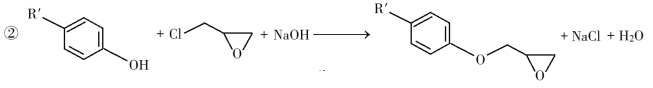
 回答下列问题:
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为__________、__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、__________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com