
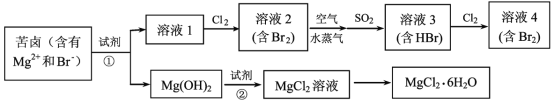
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl26H2O的流程如图:
(1)海水淡化的方法有蒸馏法、___(任写一种)等,考虑成本及效益试剂①可选用___。
(2)比较溶液中Br2的浓度:溶液2___溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是__。
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作包括____。
【答案】电渗析法(或离子交换法) CaO或Ca(OH)2 < SO2+Br2+2H2O=2HBr+H2SO4 蒸发浓缩,降温结晶
【解析】
由流程图可知,向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,过滤;向溶液1中通入氯气,氯气与溶液中的溴离子发生置换反应生成含有浓度较低单质溴的溶液2,用空气和水蒸气吹出溴蒸气,溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸的溶液3,再向所得溶液3通入氯气得到含溴浓度较高的溶液4,将氢氧化镁溶于盐酸中得到氯化镁溶液,氯化镁溶液蒸发浓缩,冷却结晶,过滤得到六水氯化镁。
(1)海水淡化的方法主要有蒸馏法、离子交换法、电渗析法等。向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,考虑成本及效益试剂①可以选用CaOH)2或生石灰,故本题答案为:电渗析法(或离子交换法);CaO或Ca(OH)2;
(2)由分析可知,溶液2含有单质溴浓度低于溶液4,故本题答案为:<;
(3)由分析可知,溶液中溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸,反应的化学方程式为SO2+Br2+2H2O=2HBr+H2SO4,故本题答案为:SO2+Br2+2H2O=2HBr+H2SO4;
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作是蒸发浓缩,冷却结晶,过滤等操作,故本题答案为:蒸发浓缩,降温结晶。


科目:高中化学 来源: 题型:
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是
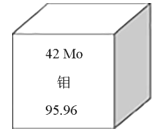
A.95Mo18O42-(钼酸根离子)中共计有76个电子
B.Mo元素是第五周期的主族元素
C.92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D.98Mo的原子核内中子数比质子数多14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据各概念图作出的判断,正确的是
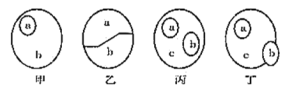
A. 在植物细胞内,甲图中a和b可以表示淀粉和葡萄糖的关系
B. 若乙中a和b分别代表DNA和RNA,则乙图可以代表病毒内的核酸
C. 丙图中a、b、c可分别表示磷脂、固醇和脂质之间的关系
D. 丁图a、b、c可分别表示蛋白质、激素和酶之间的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)△H=-128.1kJ·mol-1
CH3OH(g)△H=-128.1kJ·mol-1
回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有_____。
A、升高温度 B、增大压强 C、充入氢气 D、分离出甲醇
(2)恒温恒容条件能说明该可逆反应达平衡的是_________;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中充入1molCO(g)和2molH2(g)。实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示。
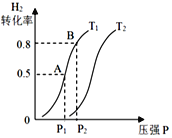
①该反应的△S____0,图中的T1___T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为______,若达到平衡状态B时,则容器的体积V(B)=______L。
(4) CO燃烧的热化学方程式:CO(g)+ 1/2 O2(g)═CO2(g)△H= —283.0kJmol-1
H2(g)+1/2 O2(g)═H2O(l)△H= —285.8 kJmol-1
CO(g)+2H2(g)═CH3OH(l)△H= —128.1KJmol-1
则CH3OH(g)燃烧热的热化学方程式是为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )

A.该反应的有机生成物有四种,都为液体B.该反应的条件是光照,但是不能放在日光直射的地方
C.该反应属于取代反应D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是
A. 碳原子的轨道表示式:![]() B. 次氯酸分子的电子式:
B. 次氯酸分子的电子式:![]()
C. CH4Si的结构式:![]() D. 质量数为137的钡原子:56137Ba
D. 质量数为137的钡原子:56137Ba
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl和20mL0.1000mol/LCH3COOH,得到如图所示两条滴定曲线,下列说法不正确的是( )
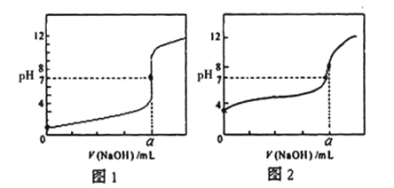
A.图1表示NaOH滴定盐酸的曲线
B.a=20mL
C.图2中,pH=7,c(CH3COO-)=c(Na+)
D.图1中,由水电离的c(H+)一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在医药卫生、高纯度金属提炼、光学仪器等领域起着至关重要的作用。从含碘化钾废液(可能还含有I2、IO3-)中回收I2,实验过程如下:
(1)确定碘的存在形式
①I2的确定:取含碘废液放入试管,加入CCl4,振荡静置,现象为_____,确定含有I2。
②IO3-的确定:取①中上层溶液,加入少量新配制的0.1mo/LFeSO4溶液,它的作用是____。振荡使之充分反应,再加入少量CCl4,CCl4层无紫色出现,说明该含碘废液中无IO3-。
(2)碘的回收
在含碘废液中加入适量的K2Cr2O7溶液和稀H2SO4,充分反应后经减压过滤得到粗碘,由粗碘提纯精制碘的装置如图:
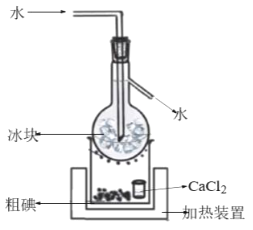
①补全得到粗碘的离子方程式:______。
□Cr2O72-+□I-+□ =□ +□Cr3++□ 。
②CaCl2的作用是__。
(3)碘的纯度分析(已知:2S2O32-+I2=2I-+S4O62-)
精确量取0.1136g精制后的碘置于250mL碘量瓶中,加入0.5gKI和30mL水,振荡至完全溶解(KI仅用于溶解)。以0.0513mol·L-1的Na2S2O3溶液快速滴定至淡黄色,加入1mL左右淀粉溶液,缓慢滴定至____,消耗Na2S2O3溶液17.26mL。碘的纯度的计算表达式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是化学反应中的能量变化图,该反应方程式为A2+B2==2AB,回答下列问题

(1)该反应中,反应物断键吸收的能量为_______________kJ/mol,生成物成键释放的能量为_______________kJ/mol属于_______________(填“放热”“吸热”)反应,该反应的该反应的△H=_______________(用字母写出表达式)
(2)已知反应有下列反应
①Fe+2HCl=FeCl2+H2↑ ②H2SO4+2NaOH=Na2SO4+2H2O
③CO+CuO=Cu+CO2↑ ④Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
与图片所示化学反应热效应相同的是_______________(填序号)
(3)以下说法正确的是_______________
A.中和反应是吸热反应
B.铝热反应需要在高温条件下进行,铝热反应属于吸热反应
C.放热反应发生时有可能需要加热
D.凡是放出热量的化学反应均可用来造福人类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com