
| A、在常温常压下,14g氮气所含氮原子数目为 NA |
| B、金属铁从盐酸中置换出1 mol H2,电子转移数为3NA |
| C、500 mL 0.5 mol?L-1Al2(SO4)3溶液中,SO42-离子的数目为0.25NA |
| D、1.7 g氨气所含的电子数目为10 NA |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L H2O含有的分子数为 NA |
| B、常温常压下,1.42g Na2SO4含有的Na+离子数为0.02 NA |
| C、通常状况下,NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6g钠与足量水反应,生成Na+离子的数目为0.2NA |
| B、标准状况下,4.48L水中含有H2O分子的数目为0.2NA |
| C、0.3mol 氯气中含有Cl原子的数目为0.3NA |
| D、0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用8%的盐酸蒸发浓缩获得30%的盐酸 |
| B、光纤和餐桌上的瓷盘都是硅酸盐制品 |
| C、可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
| D、二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 取适量固体与试管中,加适量蒸馏水使其溶解, |
| 实验一:取黄豆大小的Na与冷水反应;取表面积比Na大的、刚打磨过的Mg条与热水反应,观察反应现象; | 现象:Na与水反应比Mg与水反应剧烈; 结论:金属性:Na>Mg; |
| 实验二: | 现象: 结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:
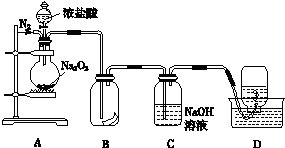
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com