
【题目】2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大。请完成下面问题:
(1)冶炼后的铝渣中含有大量的硅酸铝钙(Al2Ca2Si5O15),可作耐火纤维的原料。硅酸铝钙用氧化物形式表示为______________________。
(2) 由下列物质冶炼相应金属时采用电解法的是 。
a. Fe2O3 b. NaCl c. Cu2S d. Al2O3
(3)高铁电池具有容量高、安全性能好和价格低廉等特点,如图是高铁电池的实验装置。

已知:放电后两极得到相同价态铁的化合物。
①电池放电时正极发生的电极反应式是______________________。
②若该电池属于二次电池,则充电时阴极的电极反应式为_______________________。
③已知盐桥中含有饱和KCl溶液,放电时,盐桥的作用是_________________。
【答案】
(1)2CaO·Al2O3·5SiO2;(2)bd
(3)①FeO42-+3e-+4H2O=Fe(OH)3+5OH-;②Fe(OH)3+3e-=Fe+3OH-
③形成闭合回路,并保持两边溶液呈电中性
【解析】
试题分析:(1)硅酸铝钙(Al2Ca2Si5O15),用氧化物形式表示为2CaO·Al2O3·5SiO2,故答案为:2CaO·Al2O3·5SiO2;
(2) 在金属活动性顺序表中位于铝前面的金属冶炼时一般采用电解法,故选bd;
(3) ①FeO42-在正极得电子生成Fe3+,生成其电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;
②充电时Fe(OH)3在阴极得电子生成Fe,其电极反应式为:Fe(OH)3+3e-═Fe+3OH-,故答案为:Fe(OH)3+3e-═Fe+3OH-;
③盐桥中含有饱和KCl溶液,盐桥能够使装置形成闭合回路,并保持两边溶液呈电中性,故答案为:形成闭合回路,并保持两边溶液呈电中性。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、下列操作中,错误的是_ _
⑴用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
⑵给盛有液体的试管加热时,液体的体积不能超过容积的![]()
⑶用酸式滴定管量取23.10mL溴水
⑷将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑸提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再趁热过滤,干燥的方法
⑹取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着手心
⑺用坩埚钳夹取加热后的蒸发皿
⑻将滴管垂直伸进试管内滴加液体
⑼稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑽检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
⑾ 用10mL量筒量取5.2mL浓硫酸;
⑿用分液漏斗分离苯和四氯化碳的混合物;
Ⅱ、⑴高锰酸钾溶液常用于物质的定性检验与定量分析。
①实验室里欲用KMnO4固体来配制480 mL 0.1000 mol·L-1的KMnO4酸性溶液。
所用的仪器有天平、药匙、烧杯、玻璃棒、量筒、___ _、___ _。
②下列操作对实验结果的影响偏小的是__ __(填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.天平的砝码生锈
⑵、某化学兴趣小组,用新配制的酸性KMnO4溶液来测定某试剂厂生产的FeSO4溶液中Fe2+的物质的量浓度。
①写出酸性高锰酸钾与FeSO4溶液反应的离子方程式: 。
②该小组在测定过程中发现,测得的Fe2+的物质的量浓度比标签上的标注值要低,可能导致该测定结果的原因之一是FeSO4溶液变质; 证明方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),则下列说法正确的是
CH3OCH3(g)+H2O(g),则下列说法正确的是
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正反应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2、CO、CH4的燃烧热分别为ΔH1=-285.8 kJ/mol、ΔH2=-283 kJ/mol、ΔH3=-890 kJ/mol。H2O(g)=H2O(l) ΔH4=-44 kJ/mol。回答下列问题:
(1)用CH4替代水煤气作家用燃气的优点是____________________。将煤气灶改为天然气灶时,应适当调_________(填“大”或“小”)空气进气阀门。
(2)合成氨厂一般采用烃(以CH4为例)和水蒸气反应制取原料气H2,发生如下反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①该反应的ΔH=________________。
②当该反应达到平衡状态时,下列说法一定正确的是__________(填字母)。
A.v(CH4)=v(CO) B.加入催化剂,ΔH不变
C.升高温度,平衡常数K增大 D.CH4与H2O的转化率相等
③T℃时,该反应的初始浓度与起始速率的部分数据如下:
初始浓度/mol·L-1 | 起始速率/mol3·L-3·s-1 | |
c(CH4) | c(H2O) | v |
0.10 | 0.10 | 1.0×10-4 |
0.10 | 0.20 | 4.0×10-4 |
0.30 | 0.20 | 1.2×10-3 |
写出起始速率与初始浓度的关系式[用c(CH4)、c(H2O)及适当的速率常数表示]v=________。
④T℃时,在一个体积可变的恒压密闭容器中,充入0.1 mol CH4、0.1 mol H2O(g)发生反应,起始时容器的体积为1 L。CH4的转化率与反应时间的关系如图中曲线A所示。则T℃时该反应的平衡常数K=____________。若温度与投料方式相同,该反应在容积为1 L的恒容密闭容器中进行,刚达平衡状态的点是__________(选填B、C、D、E)。
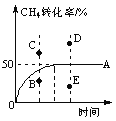
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“物质的组成和结构决定物质性质,物质的性质决定了物质的用途”。请分析:
(1)金刚石很硬,而石墨却很软。原因是 。
(2)氢氧化钠和氢氧化钡溶液都能使无色酚酞试液变红。原因是 。
(3)CO具有可燃性,可以做燃料;CO具有还原性,可以用来 。(答一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中,不正确的是
A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1
B.在该温度下,反应的平衡常数K=5
C.若将容积缩小为原来的一半,NO转化率大于90%
D.使用催化剂可以提高单位时间CO和NO的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )

A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com