
【题目】二氧化硅是制造光导纤维的重要原料,其晶体类型属于
A. 原子晶体 B. 离子晶体 C. 分子晶体 D. 金属晶体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N![]() N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________。
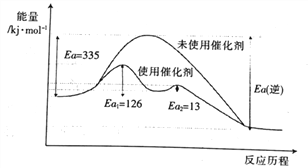
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
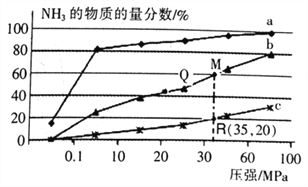
①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25 g/L;B与C在浓琉酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(1)A的电子式为__________,C中官能团的名称为 ____________。
(2) 丙烯酸(CH2 =CH -C00H)的性质可能有__________。
a.加成反应 b.取代反应 c.加聚反应 d.中和反应 c.氧化反应
(3)用两种方法鉴别B和C,所用试剂分别 ______、________。
(4)丙烯酸乙酯的结构简式为______________。
(5)写出下列反应方程式:
①___________________________。
③___________________________。
⑤___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BCl3的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应。
(1)选用下图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为________。
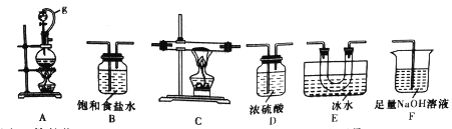
(2)图中g管的作用是______,装置E的作用是_______。
(3)开始实验时,先点燃____(填“A”或“B”)处的酒精灯。
(4)请写出BCl3遇水变质的化学方程式___________。
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中电离方程式是______。
(6)实验完成后,某同学向F (溶液中含有0.05 mol/LNaC10、0.05 mol/LNaCl、0.1 mol/L NaOH)中滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红溶液 | 现象 |
① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
x=_______,结论:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2 MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子排布式为___________。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____晶体,其电子式为______。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为____(标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为_____;列举与AlH4-空间构型相同的两种离子:_____(填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____个;NaAlH4晶体的密度为____g/cm3(用含a 的代数式表示)。
(6)NaAlH4的释氢机理为:每3个AlH4-不中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,下列有关说法错误的是
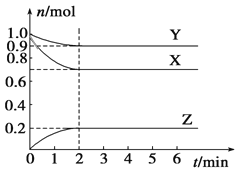
A. 该反应的化学方程式为3X+Y![]() 2Z
2Z
B. 2 min时,反应达最大限度,但化学反应仍在进行
C. 2 min末时,Z的反应速率为0.05 mol·L-1·min-1
D. 反应达到平衡时,压强是开始时的0.9倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:____________,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+____________,BF3____________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式____________、_________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 12g石墨烯( )中含有C—C键的数目为1.5NA
)中含有C—C键的数目为1.5NA
B. 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA
C. 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA
D. 在KClO3+6HCl(浓) === KCl+ 3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小
B. 常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
C. N2(g)+3H2(g) ![]() 2NH3(g) △H <0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g) △H <0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com