
����Ŀ�����ǵ�IIIA��Ԫ�أ��������ڼ���������������ַǽ�����Ӧ��ijͬѧ�����������͵�����Ӧ�Ʊ����Ȼ�����֪BCl3�ķе�Ϊ12.5�棬�۵�Ϊ-107.3�棬��ˮ���ҷ�Ӧ��
��1��ѡ����ͼ��ʾ��װ�ã������ظ�ѡ�ã�����ʵ�飬װ���������ӵĺ���˳��Ϊ________��
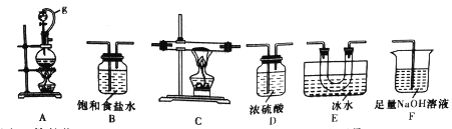
��2��ͼ��g�ܵ�������______��װ��E��������_______��
��3����ʼʵ��ʱ���ȵ�ȼ____(�A����B��)���ľƾ��ơ�
��4����д��BCl3��ˮ���ʵĻ�ѧ����ʽ___________��
��5��������һԪ���ᣬ�����λ�ѧʽΪNa[B(OH)4]����������ˮ�е��뷽��ʽ��______��
��6��ʵ����ɺ�ijͬѧ��F (��Һ�к���0.05 mol/LNaC10��0.05 mol/LNaCl��0.1 mol/L NaOH���еμ�Ʒ����Һ��������Һ��ɫ�������ʵ��̽����Һ��ɫ��ԭ���뽫�������ݲ������������ʵ�鷽����
ʵ����� | 0.1mol/LNaClO��Һ/mL | 0.1mol/LNaCl��Һ/mL | 0.2mol/LNaOH��Һ/mL | H2O /mL | Ʒ����Һ | ���� |
�� | 4.0 | 0 | 0 | x | 3�� | �Ͽ���ɫ |
�� | 0 | 4.0 | 4.0 | 0 | 3�� | ����ɫ |
�� | 4.0 | 0 | 4.0 | 0 | 3�� | ������ɫ |
x=_______�����ۣ�_______________��
���𰸡� ABDCEDF ������ѹƽ�⣬���ڷ�Һ©���е�Һ������������ƿ �������ռ�BCl3 A BCl3��3H2O=H3BO3��3HCl H3BO3��H2O![]() [B(OH)4]-��H+ 4.0 NaClOʹƷ����Һ��ɫ����Һ����Խǿ��ɫԽ����
[B(OH)4]-��H+ 4.0 NaClOʹƷ����Һ��ɫ����Һ����Խǿ��ɫԽ����
����������1�������������͵�����Ӧ�Ʊ����Ȼ�����֪�������ڼ���������������ַǽ�����Ӧ��BCl3�ķе�Ϊ12.5�棬�۵�Ϊ-107.3�棬��ˮ���ҷ�Ӧ����������Ʊ�����ྻ�����������ҷ�Ӧ�����б��з�ֹˮ�������У���AΪ��ȡ����װ�ã�Ȼ����������ͨ��Bװ���Գ�ȥ�����е��Ȼ��⣬��ͨ��Dװ�ø��������ͨ��Cװ���м�������������Ӧ�����������Ȼ����������Eװ����ȴ�ռ�������������Dװ�ø����ֹ���ˮ�������У��������F����β����������˽�����˳��Ϊ��ABDCEDF����2��ͼ��g�ܵ���������������ѹƽ�⣬���ڷ�Һ©���е�Һ������������ƿ��װ��E�����������������ռ�BCl3����3����ʼʵ��ʱ���ȵ�ȼA���ľƾ�����ȡ������ʹ���淴Ӧװ���г����������������4����д��BCl3��ˮˮ������������ἰ���ᣬ�仯ѧ����ʽ��BCl3��3H2O=H3BO3��3HCl����5��������һԪ���ᣬ�����λ�ѧʽΪNa[B(OH)4]����������ˮ�е��뷽��ʽ��H3BO3��H2O![]() [B(OH)4]-��H+����6�����ʵ��̽����ͬ��Һ��Ʒ����ɫ��ԭ��ͨ����Һ��Ũ�Ȳ�ͬ����Һ���������ͬ�����ݢڢۿ�֪����Һ�����Ϊ8.0mL����x=4.0mL��ʵ��٢���NaClO����ɫ��ʵ���û��NaClO����ɫ��ʵ�����ʵ��۶Աȣ����������£���ɫ���������Ϊ��NaClOʹƷ����Һ��ɫ����Һ����Խǿ��ɫԽ����
[B(OH)4]-��H+����6�����ʵ��̽����ͬ��Һ��Ʒ����ɫ��ԭ��ͨ����Һ��Ũ�Ȳ�ͬ����Һ���������ͬ�����ݢڢۿ�֪����Һ�����Ϊ8.0mL����x=4.0mL��ʵ��٢���NaClO����ɫ��ʵ���û��NaClO����ɫ��ʵ�����ʵ��۶Աȣ����������£���ɫ���������Ϊ��NaClOʹƷ����Һ��ɫ����Һ����Խǿ��ɫԽ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һѧϰС��������ͼ��ʾװ�ã���ij������Fe�ķ�ͭм����ͭ�����IJⶨ����̽���������Ʊ�����ͭ��Һ��

��1����A�м���10g��ͭм��Ʒ���رյ��ɼУ���B������Aע������ϡ�����رա�����ʱװ��C�в����������� ��
����Ӧ���е�A�в��ٲ�������ʱ����C���ռ���448mL���ѻ���ɱ�״�������壬��÷�ͭм��ͭ�������ٷֺ���Ϊ ��
��2��������ʹCu��ȫ�ܽ�IJ����ǣ�
�� ���C��Dװ�ú��ɼ�
��____________________________________________________________________
��3��ΪʹA�й���ӿ��ܽ����ʣ����·������ú������� ��
a.��Aװ�ü�����b.��A�ڼ�������Fe2O3��c.��A�ڼ�������CuO��d.�������ͨ������e.��A�ڼ�������FeSO4��f.��A�ڼ�������H2O
��4����A����Һ�����ձ��ڣ�����Cu2(OH)2CO3���������pH=4ʱ����Һ����Ԫ�ر���ȫ���������˺ú��ɫ����������ͭ��Һ��
���˹��̵����ӷ�Ӧ����ʽ�� ��
��������Һ����Ԫ���Ƿ���ȫ������õķ�����___________
a.ȡ�����Թܡ��μ�KSCN��Һ
b.ȡ�����Թܡ��μ�����KMnO4��Һ
c.ȡ�����Թܡ�ֽ�ϲ������ ��KSCN��Һ��
��5����ͬѧ��Ϊ�����Բ��ò������巨�����ͭм��ͭ�������ٷֺ��������������������дΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʯ���۵�Ϊa�棬�������۵�Ϊb�棬����ϩ(����ʽΪC60)���۵�Ϊc�棬�����۵�Ĵ�С��ϵ��
A. a>b>c B. b>a>c C. c>a>b D. c>b>a.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ�������й�������ȷ����
A. �����£�4.6gNO2��N2O4�������������ԭ������Ϊ0.3NA
B. 4.2g��ϩ�ͱ�ϩ��������к��еļ��Լ���ĿΪ0.8NA
C. �����£�1L0.5mol/LNH4Cl��Һ��2L0.25mol/LNH4Cl��Һ����NH4+����Ŀ��ͬ
D. 1mol������1mol�����г��ȼ�գ�ת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ӳ�����������(��ͼ��ʾ)���ڸߵ�ѹ���������õľ�Ե�ԣ��ڵ�����ҵ�������Ź㷺����;������ɢ�������л���������ЧӦ�������й����Ȼ�����Ʋ���ȷ����

A. ����������ȼ��
B. ���������и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ
C. ����������ˮ�е��ܽ��>����������CS2�е��ܽ��
D. ������������Ǽ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ά����Ҫԭ�ϣ��侧����������
A. ԭ�Ӿ��� B. ���Ӿ��� C. ���Ӿ��� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2011��6��4������22ʱ55�����ң�������Ͻ�����¾��ں��¾����ٹ�·�������Ӳ۹�й©�¹ʣ����²��ֱ���й©�������Ⱦ����й©�ı��ӣ�����Ϊ���д�ʩ���ĸ�������ѣ�
A����ˮ��ϴ�� B.��ϡ����ϴ�� C.�þƾ���ϴ�� D.��ʯ���к�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������л�����ȼ�պ�IJ�����ͨ��Ũ���ᣬŨ��������5.4g��Ȼ��ͨ����������ʯ��ˮ�У� ��ȫ���պ����˵õ�20g������ ���л��������( )
A. ��ϩ B. �Ҵ� C. ���� D. �������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com