
����Ŀ��һѧϰС��������ͼ��ʾװ�ã���ij������Fe�ķ�ͭм����ͭ�����IJⶨ����̽���������Ʊ�����ͭ��Һ��

��1����A�м���10g��ͭм��Ʒ���رյ��ɼУ���B������Aע������ϡ�����رա�����ʱװ��C�в����������� ��
����Ӧ���е�A�в��ٲ�������ʱ����C���ռ���448mL���ѻ���ɱ�״�������壬��÷�ͭм��ͭ�������ٷֺ���Ϊ ��
��2��������ʹCu��ȫ�ܽ�IJ����ǣ�
�� ���C��Dװ�ú��ɼ�
��____________________________________________________________________
��3��ΪʹA�й���ӿ��ܽ����ʣ����·������ú������� ��
a.��Aװ�ü�����b.��A�ڼ�������Fe2O3��c.��A�ڼ�������CuO��d.�������ͨ������e.��A�ڼ�������FeSO4��f.��A�ڼ�������H2O
��4����A����Һ�����ձ��ڣ�����Cu2(OH)2CO3���������pH=4ʱ����Һ����Ԫ�ر���ȫ���������˺ú��ɫ����������ͭ��Һ��
���˹��̵����ӷ�Ӧ����ʽ�� ��
��������Һ����Ԫ���Ƿ���ȫ������õķ�����___________
a.ȡ�����Թܡ��μ�KSCN��Һ
b.ȡ�����Թܡ��μ�����KMnO4��Һ
c.ȡ�����Թܡ�ֽ�ϲ������ ��KSCN��Һ��
��5����ͬѧ��Ϊ�����Բ��ò������巨�����ͭм��ͭ�������ٷֺ��������������������дΪ�� ��
���𰸡���1����ˮ���½���ˮ˳����������D�� ��2�֣� ��88.8% ��2�֣�
��2��������������ͨ��A�У���A�й���ȫ����ʧ����2�֣��ټ���ͨ��һ��ʱ������رյ��ɼУ�ֹͣͨ���������2�֣�
��3��a b d e ��2�֣�
��4����Cu2(OH)2CO3 + H+ + Fe3+ = 2Cu2+ + Fe(OH)3�� + CO2����2�֣� ��c ��2�֣�
��5������4�������ú��ɫ����ϴ�ӡ�������������㣨2�֣�
��������
�����������1����A�еķ�ͭм����������ϡ���ᷴӦ����������װ��C����ˮ����װ�ã�������C��Һ���½���ˮ���ŵ�D�У�
��10g��ͭм��Ʒ����Ӧ���е�A�в��ٲ�������ʱ����C���ռ���448mL���ѻ���ɱ�״��������Ϊ�������ʵ���Ϊ0.02mol��Fe+H2SO4=FeSO4+H2���������ʵ���Ϊ0.02mol������Ϊ0.02mol��56g/mol=1.12g���÷�ͭм��ͭ�������ٷֺ���=(10g1.12g)/10g��100%=88.8%��
��2�����C��Dװ�ú��ɼУ�����������ͨ��A�У��������ᷴӦ���ɵ������������ᱻ�����е���������Ϊ�������������Ӿ����������������ܽ�ͭ����A�й���ȫ������ʧ��Ӧ�����ӷ���ʽΪ��4Fe2++O2+4H+=4Fe3++2H2O��2Fe3++Cu=2Fe2++Cu2+���ټ���ͨ��һ��ʱ������رյ��ɼУ�ֹͣͨ�����.
��3��ΪʹA�й���ӿ��ܽ�����:
a����Aװ�ü��ȣ���ӿ췴Ӧ���ʣ���a��ȷ��
b����A�ڼ�������Fe2O3���ܽ���Զ�������Ũ�Ȼ�����ܽ�ͭ�ķ�Ӧ���ʣ���b��ȷ��
c����A�ڼ�������CuO�������ᷴӦ���ܼӿ��ܽ����ʣ���c����
d���������ͨ�������Զ�����Ũ�ȿ�����߷�Ӧ���ʣ���d��ȷ��
e����A�ڼ�������FeSO4����������������Ũ���ܼӿ췴Ӧ���ʣ���e��ȷ��
f����A�ڼ�������H2O��ϡ����ҺŨ�ȣ���Ӧ���ʼ�С����f����
��ѡabde��
��4������A����Һ�����ձ��ڣ�����Cu2��OH��2CO3���������pH=4ʱ����Һ��������ȫ���������˺ú��ɫ����������ͭ��Һ���˹������ӷ�Ӧ����ʽ��:
Cu2��OH��2CO3+H++Fe3+=2Cu2++Fe��OH��3��+CO2��
����Ϊǰ����Ԫ�ض���Fe3+ ������Ҫ�����Ƿ���ȫ���������Լ���KSCN��Һ���м��飬����û�к�ɫ������˵����Ԫ�ر�������ȫ��
��5�����ò������巨���������ݳ����������ⶨ������������������������Ԫ���������õ�ͭ�������������ͭм��ͭ�������ٷֺ���������ʵ�鷽��Ϊ���õ���������������ϴ�ӡ��������������.


 ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL 0.2mol/L H2A��Һ�еμ�0.2 mol/L NaOH��Һ����AԪ�ص��й������ʵ����仯����ͼ��ʾ������ͼʾ�жϣ�����˵����ȷ����
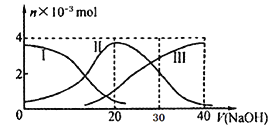
A. H2A��ˮ�еĵ��뷽��ʽ�ǣ�H2A== H++HA-��HA-![]() H++A2��
H++A2��
B. �������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
C. ��V(NaOH)=30mLʱ����Һ�д������¹�ϵ��2c(H+)+ c(HA-)+ 2c(H2A)��c(A2-)+2c(OH-)
D. ��V(NaOH)=20mLʱ����Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c(Na+)��c(HA-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�鹹�뽫����β��(NO��NO2)ת��Ϊ��Ҫ�Ļ���ԭ��HNO3����ԭ����ͼ��ʾ������A��BΪ�������ϡ�����˵��һ����ȷ���ǣ� ��
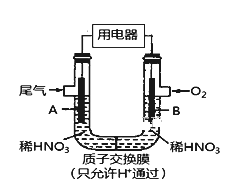
A. �õ�ع���ʱ�����ӵ��������·��A��B���ڵ�·��B��A�γɱպϻ�·
B. �缫B������HNO3Ũ������
C. A�缫�ķ�ӦΪ��NO2��e����H2O==NO3-��2H�� NO��3e����2H2O===NO3-��4H��
D. �õ�ع���ʱ��ÿ����11.2LO2(��״����)�����Գ�ȥ��1molNO��NO2�Ļ��β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C��s��+CO2��g�� 2CO��g���ķ�Ӧ�У��ֲ�ȡ���д�ʩ������С���������ѹǿ ������̼���� ���ۺ��ݳ���CO2 �ܺ����³���N2 �� ��ѹ�³���N2���ܹ�ʹ��Ӧ��������Ĵ�ʩ�ǣ�������
A. �٢�B. �ڢۢ�C. �٢�D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ǰѲ�1molij��ѧ�������ĵ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȡ�
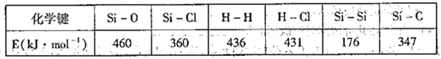
��ҵ�ϸߴ����ͨ�����з���ȡ:SiCl4(g) +2H2(g)= Si(g) +4HCl(g),(��֪ lmol����Si��2molSi -Si����,�÷�Ӧ����������Ϊ
A. ����45kJ mo1-1 B. �ų�412 kJ mo1-1
C. ���� 236 kJ mo1-1 D. �ų�236 kJ mo1-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⣬Υ����ѧ�仯���ɵ��ǣ� ��
A. ʯī�Ƴɽ��ʯB. ú����������ʯ��
C. ˮ�������D. ��ˮ�������Ի��ˮΣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ�����Ʒ���й㷺��;����ҵ�Ͽ����������͵����ϳɡ�
(1)��֪����:N![]() N 945kJ��mol-1��H-H 436 kJ��mol-1��N-H 391kJ��mol-1��
N 945kJ��mol-1��H-H 436 kJ��mol-1��N-H 391kJ��mol-1��
�ٵ����������ϳɰ����Ȼ�ѧ����ʽ��______________��
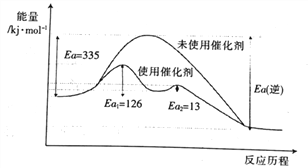
��δʹ�ô���ʱ���淴Ӧ�Ļ��Ea(��)=______ kJ��mol-1��ʹ�ô���֮������Ӧ���ܻ��Ϊ_______ kJ��mol-1��
(2)�±��ǵ���Ӧ���а�n(N2):n(H2)=l:3Ͷ�Ϻ���200�桢400�桢600�棬��Ӧ�ﵽƽ��ʱ���������NH3�����ʵ�����������ѹǿ�ı仯���ߡ�
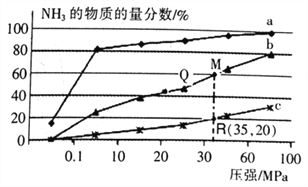
������a��b��Ӧ�¶Ƚϸߵ���________ (����a������b��)
��ʵ����ģ�ҵ�ϳɰ���һ���¶Ⱥ�ѹǿ����1L�ܱ�������ͨ��5 mol N2��15molH2��10min ��ﵽM��ƽ��״̬������ӷ�Ӧ��ʼ��ƽ��ʱ����ڵ�ƽ������V(N2)___mol��L-1��min-1��
�۹��ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ����_______(����ĸ)��
A.�����NH3���ԭ����ѭ�����ã��������H2��ƽ��ת����
B.ʹ�ݴ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C.��ͼ��M��Q��R��ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)= K(Q)> K(R)
���г�R��ƽ�ⳣ���ļ���ʽKp=____(MPa)-2������ƽ���ѹ����ƽ��Ũ�ȼ��룬��ѹ=��ѹ�����ʵ�����������Ҫ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ��ˮ���ܼ����һ��������
A���������ᡢ���Ȼ�̼ B���Ҵ�����ȩ������
C���屽���Ҷ����������� D�������������Ҵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ�IIIA��Ԫ�أ��������ڼ���������������ַǽ�����Ӧ��ijͬѧ�����������͵�����Ӧ�Ʊ����Ȼ�����֪BCl3�ķе�Ϊ12.5�棬�۵�Ϊ-107.3�棬��ˮ���ҷ�Ӧ��
��1��ѡ����ͼ��ʾ��װ�ã������ظ�ѡ�ã�����ʵ�飬װ���������ӵĺ���˳��Ϊ________��
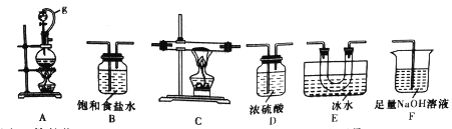
��2��ͼ��g�ܵ�������______��װ��E��������_______��
��3����ʼʵ��ʱ���ȵ�ȼ____(�A����B��)���ľƾ��ơ�
��4����д��BCl3��ˮ���ʵĻ�ѧ����ʽ___________��
��5��������һԪ���ᣬ�����λ�ѧʽΪNa[B(OH)4]����������ˮ�е��뷽��ʽ��______��
��6��ʵ����ɺ�ijͬѧ��F (��Һ�к���0.05 mol/LNaC10��0.05 mol/LNaCl��0.1 mol/L NaOH���еμ�Ʒ����Һ��������Һ��ɫ�������ʵ��̽����Һ��ɫ��ԭ���뽫�������ݲ������������ʵ�鷽����
ʵ����� | 0.1mol/LNaClO��Һ/mL | 0.1mol/LNaCl��Һ/mL | 0.2mol/LNaOH��Һ/mL | H2O /mL | Ʒ����Һ | ���� |
�� | 4.0 | 0 | 0 | x | 3�� | �Ͽ���ɫ |
�� | 0 | 4.0 | 4.0 | 0 | 3�� | ����ɫ |
�� | 4.0 | 0 | 4.0 | 0 | 3�� | ������ɫ |
x=_______�����ۣ�_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com