
【题目】六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氯化硫的推测正确的是

A. 六氟化硫不能燃烧
B. 六氟化硫中各原子均达到8电子稳定结构
C. 六氟化硫在水中的溶解度>六氟化硫在CS2中的溶解度
D. 六氟化硫分子是极性分子
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
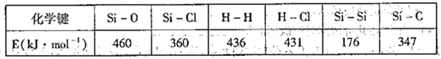
工业上高纯硅可通过下列反制取:SiCl4(g) +2H2(g)= Si(g) +4HCl(g),(已知 lmol晶体Si中2molSi -Si键),该反应产生的热量为
A. 吸收45kJ mo1-1 B. 放出412 kJ mo1-1
C. 吸收 236 kJ mo1-1 D. 放出236 kJ mo1-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作A是 ______________(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是_________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上制取金属镁时是电解熔MgCl2电解反应方程式为_________。
(4)上图中虚线框内流程的主要作用是____________。写出溴水中通入S02时反应的离子方程式___________。
(5)上图中虚线框内流程也可用![]() 替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25 g/L;B与C在浓琉酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(1)A的电子式为__________,C中官能团的名称为 ____________。
(2) 丙烯酸(CH2 =CH -C00H)的性质可能有__________。
a.加成反应 b.取代反应 c.加聚反应 d.中和反应 c.氧化反应
(3)用两种方法鉴别B和C,所用试剂分别 ______、________。
(4)丙烯酸乙酯的结构简式为______________。
(5)写出下列反应方程式:
①___________________________。
③___________________________。
⑤___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧盟征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢碳纳米管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,请完成并配平下述化学方程式:
口C+口K2Cr2O7+口______=口CO2↑+口K2SO4+口Cr2(SO4)3+口H2O
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=-116kJ/mol
①下列措施中有利于增大该反应的反应速率的是_______(填字母代号)。
A.随时将CH30H与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ/mol
则表示lmol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________。
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃ 三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。

请回答:
i)在上述三种温度中,曲线Z对应的温度是_________;
ii)利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)=CH3OH(g)的平衡常数K=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BCl3的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应。
(1)选用下图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为________。
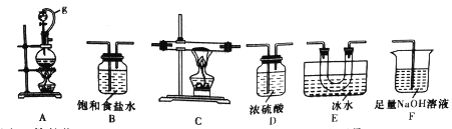
(2)图中g管的作用是______,装置E的作用是_______。
(3)开始实验时,先点燃____(填“A”或“B”)处的酒精灯。
(4)请写出BCl3遇水变质的化学方程式___________。
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中电离方程式是______。
(6)实验完成后,某同学向F (溶液中含有0.05 mol/LNaC10、0.05 mol/LNaCl、0.1 mol/L NaOH)中滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红溶液 | 现象 |
① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
x=_______,结论:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2 MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子排布式为___________。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____晶体,其电子式为______。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为____(标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为_____;列举与AlH4-空间构型相同的两种离子:_____(填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____个;NaAlH4晶体的密度为____g/cm3(用含a 的代数式表示)。
(6)NaAlH4的释氢机理为:每3个AlH4-不中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:____________,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+____________,BF3____________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式____________、_________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某NaBr和NaI固体混合物溶于水配成的400mL溶液并等分成二份。取一份,在其中滴加250mLAgNO3溶液时,恰好完全转化为沉淀。另一份中通入Cl2,充分反应后将所得的溶液蒸干、灼烧、冷却、称量。称量固体的质量与通入Cl2的体积关系如图所示。

请计算:
(1)硝酸银溶液的浓度c(AgNO3)=____mol·L-1。
(2)原混合物中m(NaBr):m(NaI)=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com