
【题目】金刚石的熔点为a℃,晶体硅的熔点为b℃,足球烯(分子式为C60)的熔点为c℃,三者熔点的大小关系是
A. a>b>c B. b>a>c C. c>a>b D. c>b>a.
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )
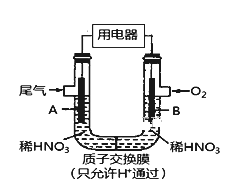
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N![]() N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________。
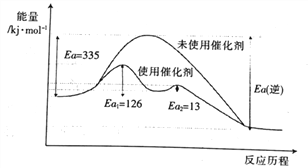
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
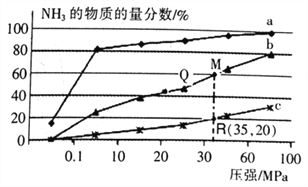
①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作A是 ______________(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是_________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上制取金属镁时是电解熔MgCl2电解反应方程式为_________。
(4)上图中虚线框内流程的主要作用是____________。写出溴水中通入S02时反应的离子方程式___________。
(5)上图中虚线框内流程也可用![]() 替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种优良的水处剂。实验室可通过以下反应值的C1O2:2KClO3+ H2C2O4 +H2SO4 ![]() 2ClO2↑+K2SO4+2CP2↑+2H2O 下列说法正确的是( )
2ClO2↑+K2SO4+2CP2↑+2H2O 下列说法正确的是( )
A. KClO3在反应中失去电子
B. H2C2O4在反应中被氧化
C. ClO2是氧化产物
D. 每消耗122.5 g KClO3就有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25 g/L;B与C在浓琉酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(1)A的电子式为__________,C中官能团的名称为 ____________。
(2) 丙烯酸(CH2 =CH -C00H)的性质可能有__________。
a.加成反应 b.取代反应 c.加聚反应 d.中和反应 c.氧化反应
(3)用两种方法鉴别B和C,所用试剂分别 ______、________。
(4)丙烯酸乙酯的结构简式为______________。
(5)写出下列反应方程式:
①___________________________。
③___________________________。
⑤___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BCl3的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应。
(1)选用下图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为________。
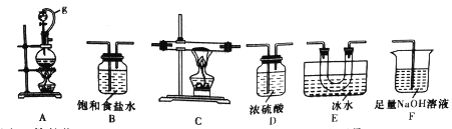
(2)图中g管的作用是______,装置E的作用是_______。
(3)开始实验时,先点燃____(填“A”或“B”)处的酒精灯。
(4)请写出BCl3遇水变质的化学方程式___________。
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中电离方程式是______。
(6)实验完成后,某同学向F (溶液中含有0.05 mol/LNaC10、0.05 mol/LNaCl、0.1 mol/L NaOH)中滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红溶液 | 现象 |
① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
x=_______,结论:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 12g石墨烯( )中含有C—C键的数目为1.5NA
)中含有C—C键的数目为1.5NA
B. 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA
C. 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA
D. 在KClO3+6HCl(浓) === KCl+ 3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com