
科目:高中化学 来源: 题型:多选题
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
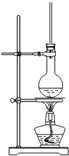
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 硫酸铜溶液 | ① | ② | ③ | ④ |
| 加入的无水硫酸铜(g) | 2.50 | 5.00 | 8.00 | 11.0 |
| 析出的硫酸铜晶体(g) | 0.10 | 4.60 | 10.0 | 15.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
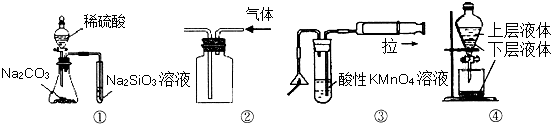
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
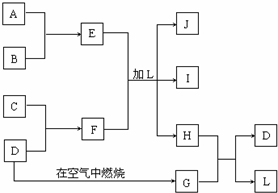 下图每一方框中的字母代表一种反应物或生成物:
下图每一方框中的字母代表一种反应物或生成物:查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
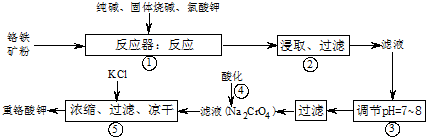
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O 2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O?NaAl(OH)4?Al(OH)3+NaOH.
2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O?NaAl(OH)4?Al(OH)3+NaOH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com