解:(1)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳,该反应为SiO
2+Na
2CO
3
Na
2SiO
3+CO
2,
故答案为:SiO
2+Na
2CO
3
Na
2SiO
3+CO
2;
(2)NaFeO
2能强烈水解,生成氢氧化铁沉淀,该水解反应为NaFeO
2+2H
2O=Fe(OH)
3↓+NaOH,故答案为:NaFeO
2+2H
2O=Fe(OH)
3↓+NaOH;
(3)③调节后溶液的pH比原来降低,是由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO
32-+H
2O
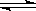
HSiO
3-+OH
-、HSiO
3-+H
2O
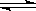
H
2SiO
3+OH
-、AlO
2-+2H
2O
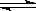
Al(OH)
3+OH
-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO
32-+H
2O
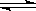
HSiO
3-+OH
-、HSiO
3-+H
2O
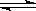
H
2SiO
3+OH
-、AlO
2-+2H
2O
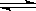
Al(OH)
3+OH
-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀;
(4)①重铬酸钾具有强氧化性,应选酸式滴定管(或移液管)量取,故答案为:酸式滴定管(或移液管);
②达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不复现,
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不复现;
③由Cr
2O
72-+6I
-+14H
+=2Cr
3++3I
2+7H
2O、I
2+2S
2O
32-=2I
-+S
4O
62- 可知,
存在Cr
2O
72-~6S
2O
32-,
1 6
所得产品中重铬酸钾纯度的代数式为
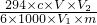
×100%,故答案为:
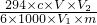
×100%.
分析:(1)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳;
(2)NaFeO
2能强烈水解,生成氢氧化铁沉淀;
(3)③调节后溶液的pH比原来降低,是因降低pH,促进水解平衡正向移动;
(4)①重铬酸钾具有强氧化性,应选酸式滴定管量取;
②达到滴定终点时颜色突变且30s不变色;
③由Cr
2O
72-+6I
-+14H
+=2Cr
3++3I
2+7H
2O、I
2+2S
2O
32-=2I
-+S
4O
62- 可知,存在Cr
2O
72-~6S
2O
32-,以此计算.
点评:本题考查混合物的分离、提纯,明确流程中操作的目的是解答的关键,注意利用关系式计算,(4)为解答的难点,题目难度中等.

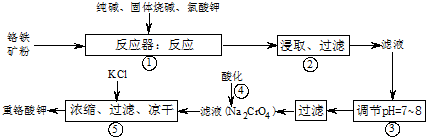
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O 2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O?NaAl(OH)4?Al(OH)3+NaOH.
2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O?NaAl(OH)4?Al(OH)3+NaOH. Na2SiO3+CO2,
Na2SiO3+CO2, Na2SiO3+CO2;
Na2SiO3+CO2;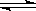 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O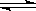 H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O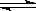 Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,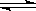 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O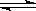 H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O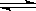 Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀;
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀;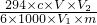 ×100%,故答案为:
×100%,故答案为: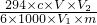 ×100%.
×100%.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
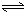 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O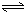 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O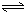 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全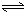 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O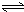 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O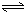 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O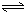 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全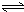 Cr2O72-+H2O
Cr2O72-+H2O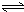 Cr2O72-+H2O
Cr2O72-+H2O
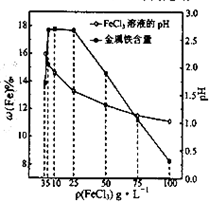 用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下: