
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
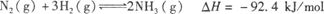 ,据此回答以下问题:
,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。
能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。
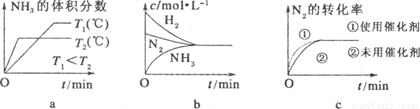
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4。
(1)①
 (2分)
②小(1分)
(2分)
②小(1分)
(2)1/12 (2分) bd (2分) (3)ac (2分) (4)< (2分) < (2分) <(2分)
【解析】
试题分析:(1)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=c2(NH3)/c(N2)c3(H2)②该反应为热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小。
N2(g)+3H2(g)⇌2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,2x/(1−x+3−3x+2x)×100%=20% 解得x=1/3,平衡常数K=1/12; 由平衡的特征“等”、“定”可判定平衡,则a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;b.该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故b正确;c.υ正(N2)=2υ逆(NH3),正逆反应速率不等,反应没有达到平衡,故c错误; d.混合气体中 c(NH3)不变,为平衡的特征,达到平衡,故d正确;(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4。
考点:化学平衡的计算;化学平衡常数的含义;化学反应速率的影响因素;化学平衡状态的判断;体积百分含量随温度、压强变化曲线;转化率随温度、压强的变化曲线。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
| 1 |
| 12 |
| 1 |
| 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com