
【题目】已知元素的原子序数,可以推断元素原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
A. ①②③ B. ①④⑤ C. ②③④ D. ③④⑤
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是
A. 移液时,不慎将液体流到瓶外
B. 容量瓶中原有少量的蒸馏水
C. 容量瓶盛过Na2CO3溶液,使用前未洗涤
D. 定容时读数仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力
B. 硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电
C. 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
D. H2和Cl2在光照条件反应生成HCl,一定有共价键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
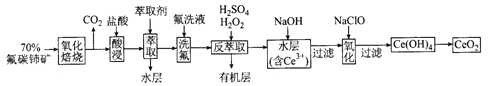
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
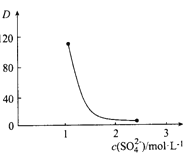
(3)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将30 g 25%的NaOH溶液和20 g 15% NaOH溶液混合,混合后溶液的密度为1.15 g·cm-3。请计算(不整除的结果保留一位小数):
(1)混合后溶液中NaOH的质量分数为 ;
(2)混合后溶液中NaOH的物质的量浓度 ;
(3)在1000 g水中需要加入 mol的NaOH恰好得到与(2)中浓度相同的溶液(忽略密度的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 因为p轨道是“8”字形的,所以p电子是“8”字形
B. 能层数为3时,有3s、3p、3d、3f四个轨道
C. 氢原子中只有一个电子,故氢原子只有一个轨道
D. 原子轨道与电子云都是用来形象描述电子运动状态的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对影响反应方向的因素的判断错误的是( )
A. 有时焓变起决定性作用 B. 有时熵变起决定性作用
C. 焓变和熵变是两个主要因素 D. 温度不可能对反应方向起决定性作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由0.5gH2、11g CO2和4g O2组成的混合气体,其体积约为
A.8.4L B.11.2L C.14.0L D.16.8L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com